2019年8月23日,复宏汉霖注射用曲妥珠单抗HLX02专家咨询会于天津顺利举行,此次会议主题为“异曲同工 映射完美生活”。来自京、津、沪、鲁的数十位肿瘤领域的专家学者莅临这次会议,共同分享和展望国产肿瘤靶向新药的临床疗效与市场前景。
“8年”研发带来乳腺癌治疗新希望"

曲妥珠单抗是HER2阳性乳腺癌及胃癌治疗的“金标准”药物,HER2阳性乳腺癌/胃癌虽然在国内拥有庞大的患者基数,但进口原研药价格之高昂令多数患者望而却步。在“健康中国”的战略引领下,复宏汉霖秉承着“患者可负担的创新”的产品开发理念,历经8年、耗费高额研发费用,打造出质高价优的曲妥珠单抗生物类似药HLX02,以期为庞大的患者群体带来治疗新希望。
国际化战略布局造就首个赴欧盟报产的国产单抗生物类似药
HLX02是国内首个参照《生物类似药研发与评价技术指导原则(试行)》进行研发,并与原研产品开展“头对头”对比的国际多中心3期临床试验的生物类似药,在全球范围内拥有广阔的市场前景。2019年4月,HLX02正式获国家药品监督管理局(NMPA)新药上市申请受理。2019年6月,捷报再次传来,HLX02正式获得向欧洲药品管理局(EMA)上市申请受理,成为首个被欧盟受理的“中国籍”曲妥珠单抗。这也意味着复宏汉霖的药政注册能力、临床研究能力和质量体系得到了国际上的进一步认可,中国自主开发的曲妥珠单抗有望尽快惠及全球更多患者。
同时,复宏汉霖亦通过国际化战略合作,助力HLX02前瞻性地开拓海外市场业务。目前,复宏汉霖已与雅各臣药业、Cipla、Accord等公司建立合作,授予雅各臣在中国香港、中国澳门的HLX02的商业化权利及东南亚若干市场的商业化权利优先洽谈权,授予Cipla在亚太和拉丁美洲地区部分新兴国家市场的开发和商业化,授予Accord在欧洲地区包括英国、法国、德国和意大利等在内的53个国家,中东及北非地区17个国家和部分独联体国家对HLX02的独家商业化许可。
项目最新进展分享再掀高潮
当日,咨询会在中国医学科学院肿瘤医天津医科大学肿瘤医院徐兵河、张瑾两位教授的致辞中拉开帷幕。中国医学科学院肿瘤医院马飞教授对生物类似药面临的机遇和挑战进行了全面的分析,复宏汉霖市场部副总经理余诚先生对注射用曲妥珠单抗HLX02的开发策略和研发亮点进行了介绍。




中国医学科学院肿瘤医院张频教授针对复宏汉霖HLX02-mBC01项目经验进行了分享,王颀、何建军、李南林、苏乌云、马杰、宋国红、谢小明、王启堂等多位临床专家围绕此话题展开热烈讨论。随后,天津医科大学肿瘤医院和山东省肿瘤医院佟仲生教授、王永胜教授担任议题主持人,各位专家教授就HLX02 的临床实践展开深入交流探讨。复宏汉霖市场总监端木传云先生就公司生物类似药产品管线展开详细介绍,各位专家纷纷建言献策。
会议临近尾声,诸位专家一致表示,期待国产肿瘤靶向药HLX02尽快进入市场,“患者可负担”的好药切实可期。
关于复宏汉霖
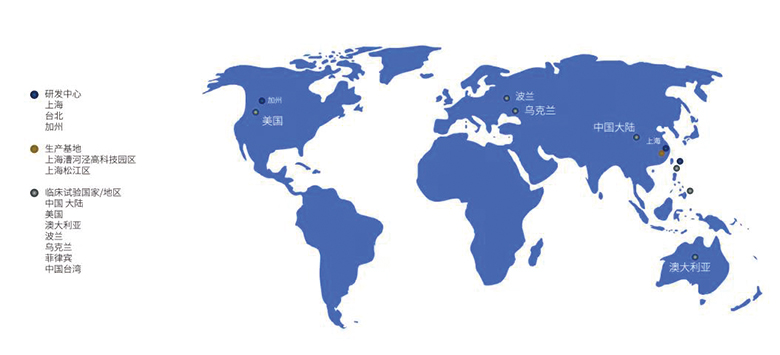
复宏汉霖是一家中国领先的生物制药公司,致力于为全球患者提供质高价优的创新生物药。自2010年成立以来,公司在上海、台北和加州均设有研发中心,已经建立并持续拓展全面的生物类似药及生物创新药产品管线,产品覆盖肿瘤、自身免疫性疾病等领域。
截至目前,复宏汉霖已有1个产品成功上市,2个产品获得新药上市申请受理,13个产品、6个联合治疗方案在全球范围内开展20多项临床试验。其中,公司首款重磅产品汉利康®(利妥昔单抗注射液)于2019年2月获国家药监局新药上市注册批准,成为中国首个获批上市的生物类似药。HLX03(阿达木单抗注射液)与HLX02(注射用曲妥珠单抗)已获国家药监局新药上市申请受理,现已纳入优先审评程序。HLX02相继在中国大陆、乌克兰、欧盟波兰和菲律宾全面启动国际多中心3期临床试验,成为国内首个开展国际多中心3期临床研究的生物类似药,并于2019年6月获欧洲药品管理局上市申请受理。
