近年来,免疫疗法在肿瘤治疗领域进展迅速,以阻断PD-1/PD-L1通路的单克隆抗体为代表的免疫检查点抑制剂,对癌症患者的治疗产生了重大影响。肿瘤免疫疗法在各类癌症中均显示了良好的临床抗肿瘤活性:包括黑色素瘤、肾细胞癌等实体瘤及血液恶性肿瘤;先前被认为无免疫应答的肿瘤,特别是非小细胞肺癌、头颈部鳞状细胞癌、胃癌、肝细胞癌、结直肠癌、膀胱癌等,也可实现多年持续应答。
全球布局,开启三地临床试验
复宏汉霖汲取生物类似药的开发经验,搭建起全面的生物创新药管线,在全球多地快速推进创新产品的临床研究。以抗PD-1/PD-L1单抗为代表的创新产品现已进入临床试验阶段:
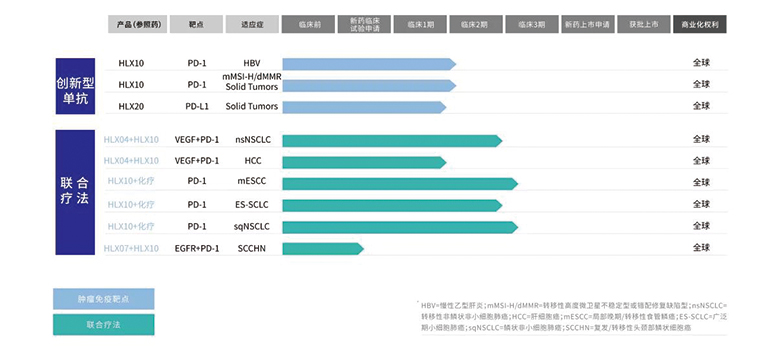
• 自主研发的HLX10(重组抗PD-1人源化单克隆抗体注射液)于2014年初开始开发,分别于2017年9月、2017年12月及2018年3月在美国、中国台湾及中国大陆三地获得新药临床试验申请批准,可用于多种实体瘤的治疗。现已在中国台湾启动1期临床试验(NCT03468751),近期获得用于慢性乙型肝炎治疗的临床批准。用于经标准治疗失败后、不可切除、转移性高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR)实体瘤适应症的2期临床研究(NCT03941574)于2019年8月完成首例病人给药。
HLX10的1期临床试验阶段性数据将在2019年中国临床肿瘤学会(CSCO)上公布,敬请期待。
• 自主研发的HLX20(重组全人抗PD-L1单克隆抗体注射液)已于2018年获中国和澳大利亚新药临床试验申请批准,并于同年在澳大利亚启动1期临床试验。
国内免疫联合疗法引领者
目前,PD-1/PD-L1联合疗法已成趋势,由于其与化疗、放疗、靶向治疗或免疫治疗等联合可以提高有效率和疾病控制率,对拓宽适应症人群及降低副作用有明显帮助,已经有很多的临床试验在探索中。我们也在大力探索其他联合治疗方案,如
• HLX10与化疗联用:
针对局部晚期/转移性食管鳞癌(ESCC)适应症的临床3期试验(NCT03958890)于2019年7月完成首例病人给药;针对局部晚期/转移性鳞状非小细胞肺癌(NSCLC)适应症的3期国际多中心临床试验(NCT04033354)于2019年8月完成首例患者给药;预期将于不久针对广泛期小细胞肺癌(SCLC)适应症开展3期国际多中心临床试验。
• HLX10与HLX04联用:
HLX10+HLX04(重组抗VEGF人源化单克隆抗体注射液)是国内首个获临床申请受理的国产单抗联合治疗方案,目前正针对转移性非鳞状NSCLC适应症筹备3期临床试验(NCT03952403)及肝细胞癌(HCC)适应症筹备2期临床试验(NCT03973112)。
• HLX10与HLX07联用:
HLX10+HLX07(抗EGFR单克隆抗体)联合疗法用于治疗头颈部鳞状细胞癌(SCCHN)的新药临床试验已获受理。
如今有效和优质的癌症治疗方式的需求仍未被满足,复宏汉霖将持续为癌症患者们服务,积极践行“仿创结合”的产品开发策略,同时打造多元化的基于自有产品(以抗PD-1/PD-L1抗体等为核心)的联合疗法组合,严格把控产品品质,为更多患者提供更可负担的、疗效更好的治疗方案。
我们将不断探索发展,携手合作伙伴共同把握肿瘤免疫治疗的机遇,引领并推动国内单抗联合治疗的发展,专注提供质高价优的生物药,成为全球最受信赖和景仰的创新生物医药公司。
参考资料:
1. 上海复宏汉霖生物技术股份有限公司2019年7月5日呈交香港联交所的《招股章程》
2. Drew Y, de Jonge M, Hong S-H, et al. An open-label, phase II basket study of olaparib and durvalumab (MEDIOLA): Results in germline BRCA-mutated (gBRCAm) platinum-sensitive relapsed (PSR) ovarian cancer (OC) . Presented at: SGO Annual Meeting; March 24-27, 2018; New Orleans, LA. Late-breaking abstract.
3. Konstantinopoulos PA, Munster P, Forero-Torres A, et al. TOPACIO: preliminary activity and safety in patients (pts) with platinum-resistant ovarian cancer in a phase 1/2 study of niraparib in combination with pembrolizumab. Presented at: SGO Annual Meeting; March 24-27, 2018; New Orleans, LA. Late-breaking abstract.
关于复宏汉霖
复宏汉霖是一家中国领先的生物制药公司,致力于为全球患者提供质高价优的创新生物药。自2010年成立以来,公司在上海、台北和加州均设有研发中心,已经建立并持续拓展全面的生物类似药及生物创新药产品管线,产品覆盖肿瘤、自身免疫性疾病等领域。
截至目前,复宏汉霖已有1个产品成功上市,2个产品获得新药上市申请受理,14个产品、6个联合治疗方案在全球范围内开展20多项临床试验。其中,公司首款重磅产品汉利康®(利妥昔单抗注射液)于2019年2月获国家药监局新药上市注册批准,成为中国首个获批上市的生物类似药。HLX03(阿达木单抗注射液)与HLX02(注射用曲妥珠单抗)已获国家药监局新药上市申请受理,现已纳入优先审评程序。HLX02相继在中国大陆、乌克兰、欧盟波兰和菲律宾全面启动国际多中心3期临床试验,成为国内首个开展国际多中心3期临床研究的生物类似药,并于2019年6月获欧洲药品管理局上市申请受理。
