乳腺癌的新辅助及辅助治疗可谓是“老生常谈”,靶向药物的应用也大大推动了乳腺癌的新辅助及辅助治疗。众所周知,人表皮生长因子2(HER2)过表达与肿瘤高侵袭性和高复发率显著相关,抗HER2单克隆抗体——曲妥珠单抗的应用大大改善了这部分患者的转归。在其“称霸”乳腺癌靶向治疗的十多年中,与其具有相同疗效、而价格更易于负担的产品开发也在快速进展中。9月20日,复宏汉霖带来了其自主研发产品HLX02(注射用曲妥珠单抗),治疗HER2阳性转移性乳腺癌患者的国际多中心3期临床数据。本文将对研究结果进行全面阐述,并邀请多位临床专家从不同角度对该研究进行解读,内容如下。
研究介绍
HLX02与原研曲妥珠单抗具有相似疗效及安全性
研究背景
乳腺癌是女性最常见肿瘤之一,全球范围内均具有较高的发病率和死亡率。曲妥珠单抗已被大量研究证明可提高HER2阳性乳腺癌患者的总体生存率,被国内外权威指南推荐应用于乳腺癌的一线治疗。
然而,生物制剂药价普遍高昂,优质药品供货时常短缺,全球范围内仍有众多乳腺癌患者无法得到曲妥珠单抗的治疗,错失优质治疗机会。HLX02是复宏汉霖自主研发的注射用曲妥珠单抗,旨在满足当前全球乳腺癌患者巨大的治疗需求。
基于其前期临床研究结果,即HLX02与不同来源的原研曲妥珠单抗(中国市售和欧洲市售)具有等效的药代动力学特性和安全性,为进一步验证HLX02与原研曲妥珠单抗(欧洲市售)的有效性和安全性,复宏汉霖在复发或未经治疗的HER2阳性转移性乳腺癌患者中开展了随机、双盲、平行对照的3期临床试验(临床试验号:NCT03084237;欧洲临床试验号:2016-000206-10)。
研究设计
试验入组649例患者,患者需满足:≥18岁且患有复发性或转移性乳腺癌、病理检测HER2阳性(FISH≥2.0或IHC得分3+)、未进行过全身性化疗或靶向药物治疗、体力状况较好(ECOG评分0~1)等条件。
将患者按照1:1的比例随机分为两组,分别给予HLX02联合多西他赛治疗与欧洲市售曲妥珠单抗联合多西他赛治疗。两组患者均采用每3周给药一次,最多12个月的方案给药。主要疗效终点为24周的最佳客观缓解率(ORR24)(图1)。
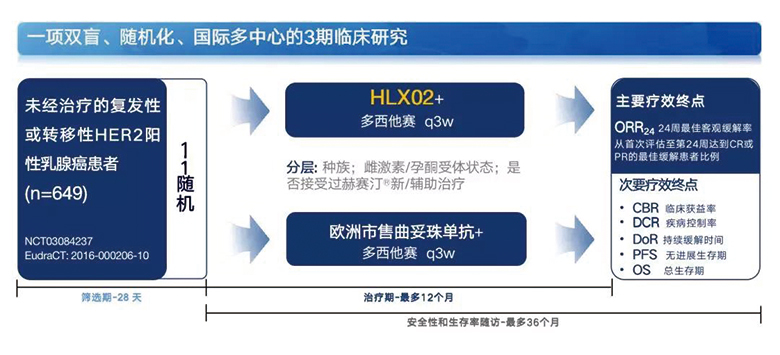
图1 研究设计流程图
研究结果
(数据截止至2018年11月27日)
有效性结果 结果显示,HLX02组24周的最佳客观缓解率为71.0%,原研组为71.4%。ORR组间差异95%可信区间(CI)为-0.4% (-7.4%, 6.6%) ,在预设等效区间内,HLX02和原研曲妥珠单抗疗效等效性成立(图2)。除此之外,亚组分析显示, HLX02组与原研曲妥珠单抗组ORR24在不同人群中无统计学差异(P>0.05),进一步验证了HLX02与原研曲妥珠单抗的疗效相似性。
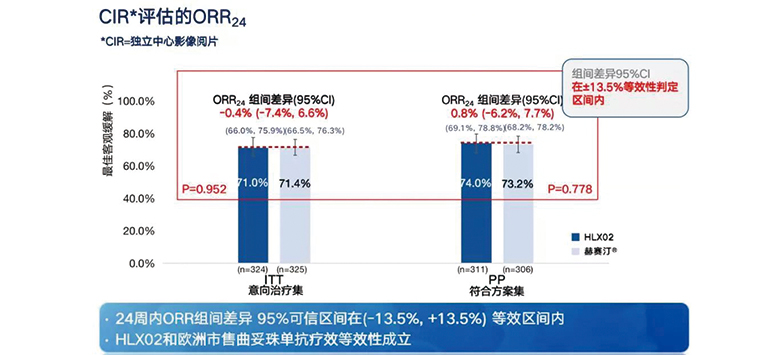
图2 24周ORR数据
次要疗效终点如临床获益率(CBR)、疾病控制率(DCR)、缓解持续时间(DoR)、无进展生存期率(PFS)、总生存率(OS)等,两治疗组间无统计学意义(P>0.05)。
安全性结果 HLX02和原研曲妥珠单抗安全性(包括心脏疾病相关的不良事件发生率)相似(P>0.05)。
结论
上述结果充分证明,在HER2阳性转移性乳腺癌患者中,HLX02和原研曲妥珠单抗疗效等效,安全性相似。
研究面面观
多亮点引发关注,期待复宏汉霖曲妥珠单抗HLX02的上市
中、欧双报国产曲妥珠单抗备受期待

近年来,得益于国家惠及民生的医保政策和生物医药行业的蓬勃发展,国内生物制剂价格已经明显下降。以HLX02为代表的高品质生物类似药的快速研发和获批上市,将进一步带来市场的良性竞争,为医生及患者提供更多治疗选择。即将公布的HLX02 3期国际多中心临床研究数据将支持HLX02获批上市,有望为中国和全球更多的HER2阳性乳腺癌患者带来获益,进一步推动全球乳腺癌规范化诊疗。
首个生物类似药国际多中心研究,研究所获结果具有重要意义

随着肿瘤生物治疗的快速发展,生物类似药领域方兴未艾。但其实,生物制剂自身结构的复杂性使生物类似药的开发难度远比想象中大。生产线上细胞株小小的改变或细胞生长条件的细微变化都可能使最终产品与预期大相径庭。
正因如此,生物类似药必须努力通过公开或已知的信息确定生物制剂的结构和其生物特性,开展逆向工程研究药物的生产过程。再通过严格的检测和不断验证,进一步确定其与原研药的表现是否相似。
HLX02(注射用曲妥珠单抗)是中国首个按照生物类似药指导原则开发并获得国家药品监督管理局(NMPA)上市申请受理的曲妥珠单抗,主要用于乳腺癌及转移性胃癌的治疗。值得注意的是,参与HLX02 3期临床研究的国家还包含波兰、乌克兰、菲律宾等国家,使HLX02成为首个进行国际多中心3期临床研究的生物类似药。上述国家的参与,贯彻了习近平主席提出的“一带一路”倡议,实现了与国际伙伴的合作共赢,也使这项研究具有更加重要的意义和价值。此外,该临床试验还获得了国家“十三五”国家重大新药创制专项、“科技创新行动计划”生物医药领域科技支撑项目的支持,其结果的成功发布也为上述国家项目后续的大力发展注入了力量。
HLX02 3期研究设计亮点颇多,研究结果更具说服力

由我国复宏汉霖自主研发的注射用曲妥珠单抗HLX02 3期研究结果的发布可谓是本次大会的亮点。曲妥珠单抗是肿瘤生物制剂中的“明星”,而HLX02在前期研发和临床研究中,更是设置了高标准的“起点”。本次发布的HLX02 3期临床试验采取随机、双盲、平行对照的国际多中心设计。其中,89个临床试验中心分布于中国、菲律宾、乌克兰和波兰等国家,研究结果更能充分说明HLX02在不同人种中的有效性及安全性,这对于未来生物类似药的研发可谓起到了良好示范作用。
另外,该研究实际入组649例,其中中国患者488例,为国内HER2阳性乳腺癌领域生物类似药最大样本量的研究。值得一提的是,研究对照组直接选用欧洲市售原研曲妥珠单抗进行头对头比较,可见复宏汉霖对于HLX02能够在有效性和安全性上获得等效结果充满信心。
此番发布的3期临床试验结果显示,HLX02和原研曲妥珠单抗两组间在主要疗效终点24周最佳客观缓解率(ORR24)上无统计学差异,次要疗效终点如临床获益率(CBR)、疾病控制率(DCR)、缓解持续时间(DoR)、无进展生存期率(PFS)、总生存率(OS)等皆无统计学差异(P>0.05),且安全性相似,充分证明了HLX02与原研曲妥珠单抗具有相似的疗效和安全性。
广阔视野全球布局,期待HLX02早日惠及患者

HLX02的开发和生产严格依据国家药品监督管理局(NMPA)和欧洲药品管理局(EMA)发布的生物类似药指导原则,其前期临床研究结果已经证实,HLX02与不同来源的原研曲妥珠单抗(中国市售和欧洲市售)具有等效的药代动力学特性和安全性,并先后被2018年中国临床肿瘤学(CSCO)年会和2018年欧洲肿瘤内科学(ESMO)-ASIA大会认可。
2019年4月,HLX02获NMPA新药上市申请受理,并于同年6月获EMA新药上市申请受理,申请适应证包括HER2阳性早期乳腺癌、转移性乳腺癌、转移性胃癌。至此,HLX02成为首个在欧盟递交上市申请并被受理的国产生物类似药,可谓真正立足于中国,拥有比肩欧盟的产品品质和能够走向世界舞台的潜力。根据NMPA药品审评中心发布的公示信息,复宏汉霖自主研制开发的注射用曲妥珠单抗HLX02已纳入优先审评程序,距其获批上市更进一步。
作为一名临床工作者,衷心希望看到原研药物不断出现的同时,优质的生物类似药能够增加高品质药物可及性,从而让全球患者获得更长的生存期。而若由我国研发生产的曲妥珠单抗能够在中国乃至世界范围内获批上市,未来这一类药物的广泛应用、联合治疗以及使肿瘤降期转化的新辅助、辅助治疗等方面将有机会进行更多探索,广大患者也可因此获得越来越多的治疗机会。在肿瘤治疗生物制剂蓬勃发展的今天,生物类似药的获批上市同样备受关注,相信随着临床安全性、有效性不断地被认可,中国人自主研发的生物类似药有机会转变为基础用药。后续也可进行更多的开发,促进市场的良性竞争,为患者带来更多获益。
从HER2阳性乳腺癌治疗现状,看HLX02“出世”的重要性

乳腺癌是女性发病率最高的恶性肿瘤,尽管乳腺癌的综合治疗水平在不断提高,其死亡率仍然位居女性肿瘤的第2位。HER2阳性乳腺癌约占全部乳腺癌的20%~25%,该类型乳腺癌侵袭性较高、预后较差。但以曲妥珠单抗为代表的抗HER2药物的出现已经显著改善了该类乳腺癌患者的治疗现状及结局,大大推进了HER2阳性乳腺癌的治疗进程。
基于HERA、BCIRG006、NCCTG N9831及NSABP B-31等一系列应用曲妥珠单抗辅助治疗的前瞻性、大样本随机临床试验的长期随访结果显示,曲妥珠单抗辅助治疗1年可以显著改善HER2阳性乳腺癌患者的预后,降低复发风险40%~50%、降低死亡风险33%。这奠定了HER2阳性乳腺癌曲妥珠单抗1年辅助治疗的标准地位,多年来,曲妥珠单抗在HER2阳性乳腺癌中的“宝座”无可撼动。近年来,对HER2阳性乳腺癌优化治疗策略进行的诸多探索,也均围绕着曲妥珠单抗展开,其在乳腺癌治疗中的基石地位可见一斑。然而,有证据表明世界范围内曲妥珠单抗使用情况不甚理想,药物可及性问题大大影响了患者接受到良好治疗的可能。
生物类似药是与已经获批的生物制剂在安全性和有效性上高度相似的生物制剂。生物类似药的引入可以提供更多治疗选择,从而改善患者获得抗HER2治疗的机会。近年来在HER2阳性乳腺癌优化治疗方案方面的探索表明,曲妥珠单抗可长时间使用并与其他全身疗法联合,而本次在CSCO大会上发布的HLX02 3期研究结果已然表明,HLX02具有与原研曲妥珠单抗相似的有效性和安全性。期待HLX02的上市可进一步增加高品质药物的可及性,在惠及更多患者的同时,在一定程度上节省国家医疗资源。
药物可及才是保证患者获益的“源泉”

随着精准医学的概念逐渐深入,近年来,肿瘤生物治疗的发展如火如荼,但其高昂的市场价格为患者和医疗机构带来了沉重的经济负担。而发展生物类似药的主要目的,就是旨在减轻患者治疗过程中的经济负担,为他们提供更多治疗机会。
曲妥珠单抗是乳腺癌的重要治疗手段之一,而我国乳腺癌治疗状况相关调研结果表明,在经济欠发达地区,HER2阳性乳腺癌患者的曲妥珠单抗使用率不到20%。自曲妥珠单抗进入医保目录后,情况虽得到了明显改善,但仍需面临地区医保水平不平衡、药品供应不足等问题,很多患者也因此失去了宝贵的治疗机会。由此可见,患者获取曲妥珠单抗这类生物制剂存在障碍,经济负担、药品供应跟不上等客观因素导致患者无药可用,令人扼腕叹息。此时,生物类似药的出现可能大大改善这一情况,解决尚未被满足的临床需求。
需注意的是,生物类似药的产品质量保证是重要前提,复宏汉霖HLX02此次发布的3期数据已充分说明其与原研曲妥珠单抗在有效性和安全性方面具有一致性,无疑将从“源头”解决患者得不到优质治疗的难题。相信随着该药上市,会有越来越多患者能够获得宝贵治疗机会以及更长的生存获益。
另外,生物类似药与原研药的生物等效性一旦被认可获批上市,有望覆盖原研药在该国内现有的所有适应证。可见,HLX02的快速发展及获批上市后将带来市场的良性竞争,会更大程度上为早期、晚期HER2阳性乳腺癌患者带来进一步生存获益,惠及更多乳腺癌患者。最重要的是,此举将进一步提高全球乳腺癌诊治的水平和效果,进一步推动乳腺癌的诊治进程。
