9月19日,复宏汉霖参与了第22届全国临床肿瘤学大会暨2019年CSCO学术年会,其自主研发的创新型全人源化重组抗EGFR单抗——HLX07在晚期实体瘤中评价其安全性的1期临床试验(NCT02648490)最新阶段性数据已由侯明模医师进行了壁报展示,具体展示信息如下:

以下为本次数据发布的详细信息:
研究背景与目的
HLX07通过作用于EGFR靶点发挥其肿瘤抑制作用,临床前研究显示相较于国内已获批的EGFR抑制剂西妥昔单抗,改良了其抗体结合片段(Fab)的HLX07具有更好的免疫原性及更强的抗体结合能力。临床前动物研究表明,与相同剂量的西妥昔单抗相比,HLX07具有更好的抗肿瘤活性和更低的毒性。
HLX07 的1期临床试验旨在评价HLX07在晚期实体瘤患者中的安全性、耐受性和初步疗效,计划获得可支持其开展1b/2期临床试验的有效数据,以验证HLX07联合化疗在晚期实体瘤患者中的安全性和有效性。
研究方案
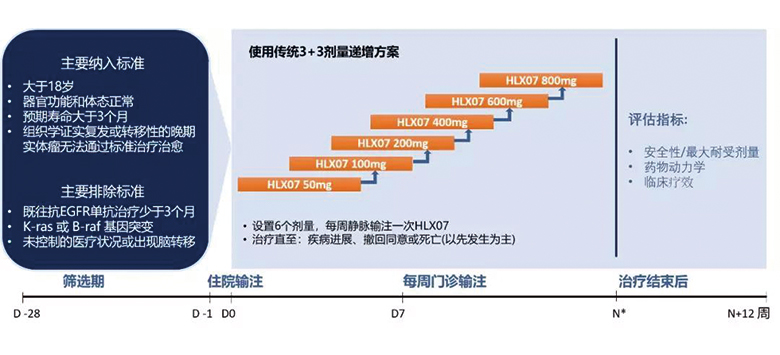
该试验在中国台湾开展,为一项评价不同剂量(50、100、200、400、600、800mg)的HLX07在晚期实体瘤患者中的安全性、耐受性、药代动力学特性和初步疗效的开放性1期试验。试验采用传统的3+3剂量递增的设计方案, 每个剂量至少入组3例受试者。入组后,患者每周静脉输注HLX07直至疾病进展、撤回同意或死亡,以先发生者为准。我们将观测HLX07平均血药浓度与剂量的关系;在研究期间评估其安全性,并根据国家中心研究所(NCI)不良事件的共同术语标准(CTCAE)4.0对不良事件进行分级;每8周通过计算机断层扫描(CT)或磁共振成像(MRI)评估一次临床疗效。
研究结果
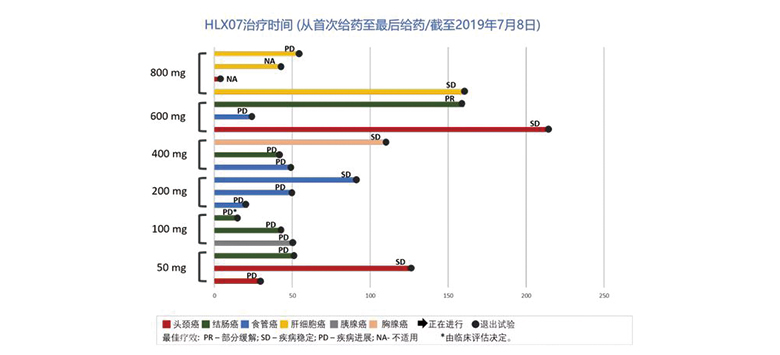
该试验共入组患者19例,中位年龄为58岁,其中男性患者占84.2%。
有效性结果
在17例可评估的患者中,观测到1例部分缓解,5例疾病稳定。
安全性结果
HLX07显示出良好的安全耐受性。6个剂量组中均未发现明显的、超出预期的不良反应(AE)。直至最高剂量组(800mg),试验中未出现剂量限制性毒性,未达到最大耐受剂量(MTD)。
结论
试验结果显示HLX07安全性数据良好,直至最高剂量组(800mg)都未达到MTD。HLX07的1期试验显示的良好安全性和初步疗效完全可以支持其开展1b/2期临床试验,以验证HLX07联合化疗在晚期实体瘤患者中的安全性和有效性。现HLX07的1b/2期临床试验已在国内启动,其与HLX10(重组抗PD-1人源化单克隆抗体注射液)联合应用于头颈部鳞状细胞癌的临床研究已获得国家药品监督管理局临床试验注册审评受理。
关于复宏汉霖
复宏汉霖是一家中国领先的生物制药公司,旨在为全球患者提供质高价优的创新生物药,产品覆盖肿瘤、自身免疫性疾病等领域。自2010年成立以来,公司以全球联动、整合创新为产品开发理念,在中国上海、台北和美国加州均设有研发中心,具备了协同增效的突出优势。复宏汉霖主要的产品开发策略是仿创结合,从生物类似药起步,逐步开发创新型单抗产品,结合自主开发的抗PD-1和PD-L1单抗,在国内率先推出免疫联合疗法,前瞻性布局了一个多元化、创新单抗及肿瘤免疫联合疗法管线,打造出研究、开发、商业化生产的综合性生物医药全产业链平台。
截至目前,复宏汉霖已有1个产品成功上市,2个产品获得中国新药上市申请受理,1个产品获得欧盟新药上市申请受理,14个产品、6个联合治疗方案在全球范围内开展20多项临床试验。其中,公司首款重磅产品汉利康(利妥昔单抗注射液)于2019年2月获国家药监局新药上市注册批准,成为中国首个获批上市的生物类似药。HLX03(阿达木单抗注射液)与HLX02(注射用曲妥珠单抗)已获国家药监局新药上市申请受理,现已纳入优先审评程序。HLX02相继在中国大陆、乌克兰、欧盟波兰和菲律宾全面启动国际多中心3期临床试验,成为国内首个开展国际多中心3期临床研究的生物类似药,并于2019年6月获欧洲药品管理局上市申请受理。此外,公司已陆续就HLX10与自有产品HLX04(贝伐珠单抗生物类似药)、HLX07(抗EGFR单抗)等单抗以及化疗联用开展多项肿瘤免疫联合疗法,在全球范围内开展多个临床研究。
