2020年3月31日,复宏汉霖(2696.HK)宣布与全球性生物技术公司Mabxience Research, S.L. (“Mabxience”) 签订独家许可协议,授予其在阿根廷、乌拉圭及巴拉圭针对注射用曲妥珠单抗HLX02在肿瘤治疗领域的开发及商业化独家权利。
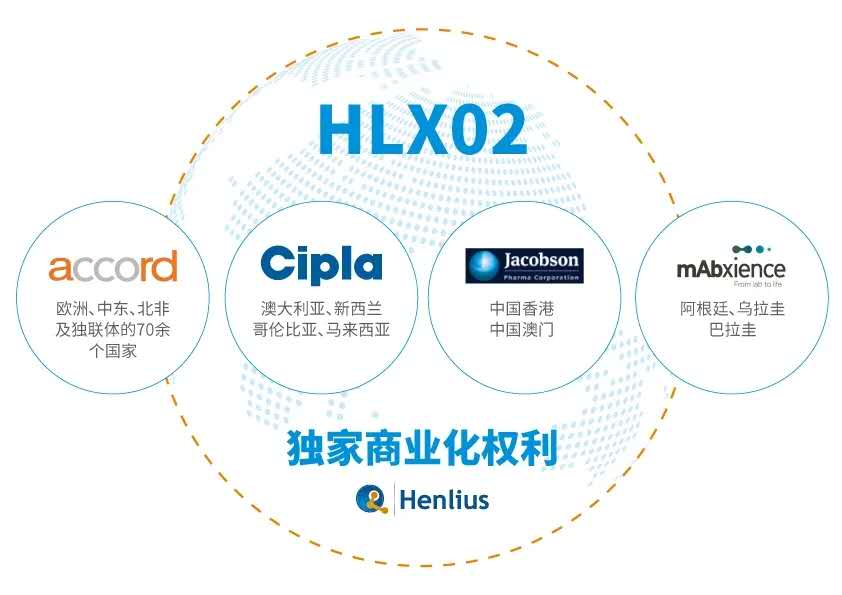
包括此项合作在内,复宏汉霖已就3大重磅产品(利妥昔单抗HLX01、曲妥珠单抗HLX02及创新型抗PD-1单抗HLX10)同多家知名国际企业达成合作,覆盖欧洲、拉丁美洲、东南亚、中东、北非等近100个国家及地区,不仅将进军欧美主流生物药市场,更是将开拓新兴市场作为全球化战略的重点。未来,秉持“可负担的创新”这一初心,复宏汉霖也将携手更多国际合作伙伴,为全球病患带来更多更好的优质生物药。
关于Mabxience
Mabxience是Insud Pharma旗下的一家全球性生物技术公司,在研发、生产和销售单克隆抗体生物类似药方面拥有十年的经验。Mabxience致力于为更多需要高成本药物的患者提供优质治疗,为医疗系统做出可持续性的贡献。Mabxience拥有三处研发及生产场所,一处位于西班牙,两处位于阿根廷。Mabxience于2014年12月推出首款生物类似药利妥昔单抗,该药现已在全球多个市场获批并分销。Mabxience的第二款产品贝伐珠单抗也于2016年11月在其首个市场推出。
截至目前,复宏汉霖已有1个产品成功上市,2个产品获得中国新药上市申请受理,1个产品获得欧盟新药上市申请受理,15个产品、8个联合治疗方案在全球范围内开展20多项临床试验。其中,公司首款重磅产品汉利康®(利妥昔单抗注射液)于2019年2月获国家药监局新药上市注册批准,成为中国首个获批上市的生物类似药。HLX03(阿达木单抗注射液)与HLX02(注射用曲妥珠单抗)已获国家药监局新药上市申请受理,现已纳入优先审评程序。HLX02相继在中国大陆、乌克兰、欧盟波兰和菲律宾全面启动国际多中心3期临床试验,成为国内首个开展国际多中心3期临床研究的生物类似药,并于2019年6月获欧洲药品管理局上市申请受理。此外,公司已陆续就HLX10与自有产品HLX04(贝伐珠单抗生物类似药)、HLX07(抗EGFR单抗)以及化疗联用开展多项肿瘤免疫联合疗法,在全球范围内开展多个临床研究。
