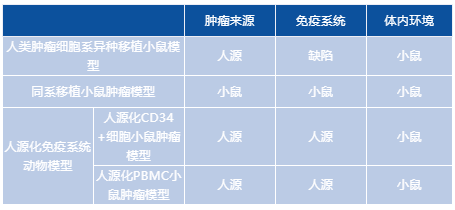
经过7年持续不断地努力与技术攻关,复宏汉霖成功建立了自有的肿瘤动物模型平台。该平台可同时饲养约2000只小鼠,包含自主构建的70余种不同的小鼠肿瘤模型,覆盖了大部分常见高发人类瘤种。其中,还包括处于国际前沿的人源化CD34+细胞小鼠肿瘤模型与人源化外周血单核细胞(PBMC)小鼠肿瘤模型,这2种模型具有人源化的免疫系统,在肿瘤免疫领域与双特异性抗体研发中的重要作用也日渐凸显。
动物疾病模型的建立,是顺利开展动物体内实验的基础。在肿瘤治疗领域,建立完善的肿瘤动物模型需要的时间、资源投入较大,同时对于研发人员的肿瘤生物学知识与实验技能的要求也非常高。正因如此,建立完善的肿瘤动物模型也成为肿瘤创新药物研发的技术壁垒之一。
采用不同方式构建的小鼠肿瘤模型具有不同的特点,可用于进行不同目的的动物体内实验。按照构建方式来看,公司目前的小鼠肿瘤模型主要有3种:(1)人类肿瘤细胞系异种移植小鼠模型;(2)同系移植小鼠肿瘤模型;(3)人源化CD34+细胞小鼠肿瘤模型以及人源化外周血单核细胞(Peripheral Blood Mononuclear Cell, PBMC)小鼠模型,这2种模型具有人类免疫系统的一些功能,其构建属于国际前沿技术。相对来说,(1)与(2)则是肿瘤药物研发中较为成熟、应用广泛的基础性动物模型。

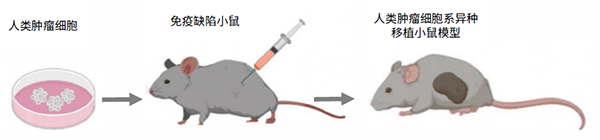
复宏汉霖已构建52种不同的人类肿瘤细胞系异种移植小鼠模型。这种模型的构建需将人类肿瘤细胞在体外进行传代培养,建立稳定的细胞株后,再将细胞株注射到免疫缺陷的小鼠体内。因此,这种模型的肿瘤组织来源于人类,肿瘤生长的机体环境则为小鼠体内环境。但由于使用免疫缺陷小鼠建立模型,这种小鼠体内没有正常的免疫系统。这种模型的优势在于,肿瘤细胞经过体外的长期传代,有高度的同源性,因此重复性好,每个细胞系都有较多的数据积累,非常便于不同研究之间进行比对。肿瘤药物的创新研发对于这种模型一直都有极大的需求。

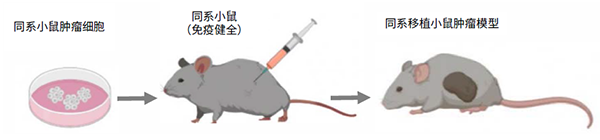
复宏汉霖目前建立了8种不同的同系移植小鼠肿瘤模型。这种模型是通过将小鼠肿瘤细胞株接种至免疫健全的近交系小鼠体内构建而成,所以这种模型的肿瘤组织和肿瘤生长的体内环境,包括免疫系统等均为小鼠来源。对于这种小鼠肿瘤模型,其肿瘤生长较为迅速,且同一批构建的肿瘤生长趋于同步,因而该模型非常适合用于抗肿瘤药物筛选。这种模型的小鼠体内有着正常的免疫系统,可以用来研究肿瘤和免疫系统的相互作用,一定程度上也可以进行肿瘤免疫治疗的概念性、机理性研究。

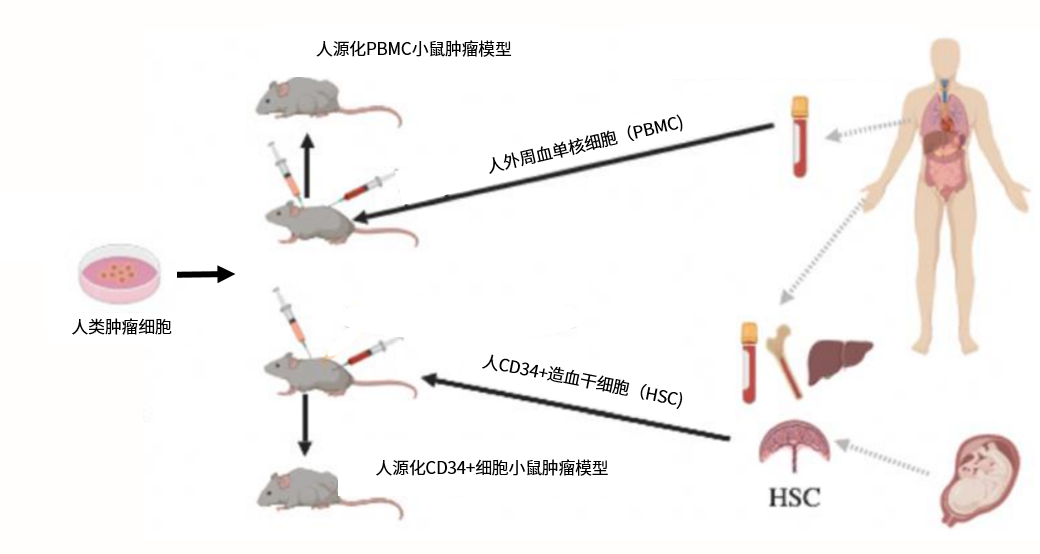

人源化PBMC小鼠肿瘤模型是将健康成人的外周血单核细胞注射至免疫缺陷的小鼠体内,由这些单核细胞在小鼠体内继续增殖与分化出人源免疫细胞。这种方式能够重建的免疫细胞类型主要为T细胞,所以非常适用于研究T细胞免疫调控相关的靶点(例如PD-1、PD-L1、CD27、OX40等)。因为这种模型既具有人源的肿瘤特异性靶点,又具有人源的T细胞相关靶点,可以直接用于各种新老靶点的双特异性乃至于三特异性抗体的研发,无需等待相应基因工程小鼠的漫长开发周期。如今,人源化PBMC小鼠肿瘤模型已经成为国际上双特异性抗体研究中领先的动物模型。目前复宏汉霖已建立12种人源化PBMC小鼠肿瘤模型,并成功应用于公司自主研发的创新型抗PD-1单抗HLX10的临床前动物体内实验。
2.Walsh NC, Kenney LL,et al. Humanized Mouse Models of Clinical Disease. Annu Rev Pathol. 2017 Jan 24;12:187-215.
3.Li E, Lin L, Chen C W, et al. Mouse Models for Immunotherapy in Hepatocellular Carcinoma[J]. Cancers, 2019, 11(11): 1800.
