间质表皮转化因子 (c-Mesenchymal-epithelial transition factor, c-Met)是受体酪氨酸激酶的一种,较早就被发现在肿瘤细胞的活动中起到重要作用。这个蛋白对于肿瘤研究领域来说并不陌生,早在2008年,Nature Review Drug Discovery就发表过一篇关于c-Met抑制剂的详细综述[1]。这么多年,涉及c-Met靶点的项目并不在少数,该靶点却又未曾如EGFR或PD-1等明星靶点一般硕果累累,屡出新药,其境遇颇像某些实力精湛却又低调为人的老戏骨。近年来,由于基础科研和临床研究的诸多新的进展和发现,尤其最近诺华卡马替尼的NDA申请被FDA受理并获得优先审评、复宏汉霖抗c-Met单抗进入临床试验阶段,让c-Met靶向药物的研发重新吸引了众人目光。c-Met这个靶点也恰似奇峰陡起,再战江湖。
c-Met过度激活:驱动癌变的关键信号
c-Met是表达在细胞表面的受体,其配体为肝细胞生长因子(hepatocyte growth factor,HGF)。HGF属于可溶性细胞因子家族,也是纤溶酶原相关生长因子家族的成员。它由间充质细胞、成纤维细胞和平滑肌细胞合成,通过旁分泌机制激活HGF/c-Met信号,发挥其生物学功能。正常生理状态下,HGF/c-Met可介导胚胎发育、细胞增殖、受伤组织修复和神经肌肉的形成,并受抑癌基因p53的调控。如同Oct4等诸多胚胎干细胞特征密切相关的基因,一旦那层窗户纸被捅破,它们往往会变成驱动生成肿瘤细胞的重要基因。
事实也确实如此。大量研究显示,c-Met被过度激活,有可能会启动正常细胞向肿瘤细胞转化,并进一步带动其侵袭、转移、扩散等后续事件的发生。细胞癌变的一个典型标志是出现上皮-间质转化(epithelial- to-mesenchymal transition),而c-Met就被认为在其中起到了关键的驱动作用。此外,c-Met基因也是肿瘤干细胞自我更新和克隆聚集重要的调控节点。
c-Met激活的细胞内下游信号通路主要方向包括:细胞增殖和分化、细胞生存、DNA修复等。当结合配体HGF后,c-Met通过形成二聚体和近膜区域若干位点的磷酸化实现活化,激活下游的一系列信号通路,启动相关的细胞生理生化功能。参与和涉及c-Met信号通路的分子,许多都是大家耳熟能详的肿瘤药物研发领域明星靶点,诸如PI3K、GRB2、STAT3、GAB1、SHP2、RAS等,这些靶点的激活往往又会带动其自身相关的更加复杂和庞大的调控网络,可谓牵一发而动全身。近年的不少临床发现也显示,c-Met基因突变正是在许多肿瘤药物耐药的关键所在。
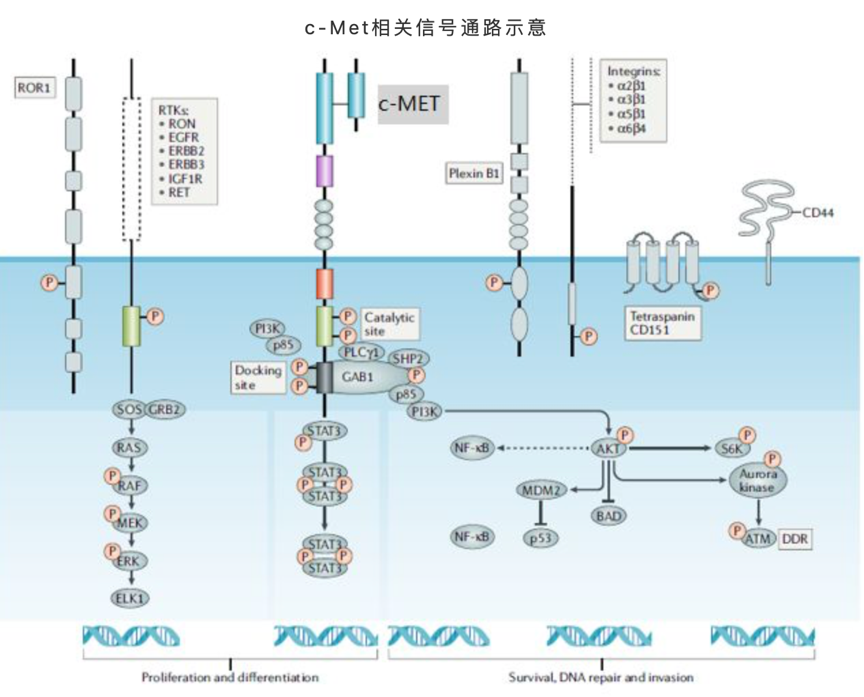
来源:Comoglio PM, et al [2]
c-Met基因异常:高频癌种的中国特色
许多癌种类型中都存在c-Met基因的异常表达,诸如脑癌、乳腺癌、结直肠癌、胃癌、头颈癌、肺癌、肝癌等。值得关注的是,c-Met基因异常表达的癌症类型中,好几种都和中国人群密切相关,最为典型的就是胃癌和结直肠癌。
胃癌是全世界第四大常见的癌症,中国是全球胃癌最高发地区,根据Globocan流行病学统计数据,2015年全球新增胃癌患者103万例,其中45万例为中国患者,占全球新增病人数的44%;且中国胃癌的初次诊断晚期比例较发达国家更高,因此带来较高的死亡率。2015年中国胃癌死亡人数约36.5万,位列国内恶性肿瘤死亡数第三位。大约10-20%的胃癌显示c-Met基因拷贝数增加;中国胃癌病人c-Met基因突变阳性率约为25%。
结直肠癌也属于中国高发疾病,发病率和死亡率均保持上升趋势。根据Globocan流行病学统计数据,2015年全球新增结直肠癌180万例,其中51万例为中国患者,占全球新增病人数的28%,且年轻人的发病率逐年增高;中国结直肠癌死亡病人数24万例,占全球结直肠癌死亡数的28%,每年递增约4%,给患者、医疗保险以及社会造成沉重负担。结直肠癌病人c-Met基因突变阳性率约为15.3%。
c-Met在不同癌种基因异常表达情况
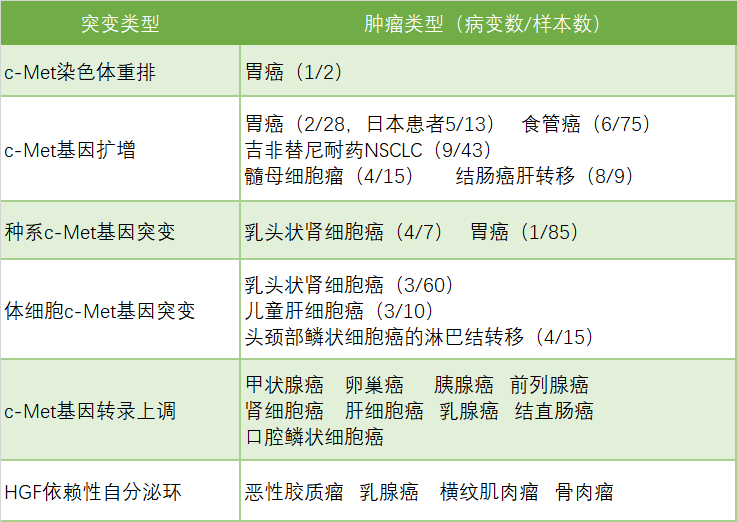
来源:Paolo M.Comoglio, et al [1]
外显子14缺失:c-Met被阻断的负向调控
如前所述,c-Met的不适当激活促进细胞增殖、细胞运动、侵袭性和血管生成,并与更具侵袭性的表型和较低的生存率相关。肿瘤细胞中,c-Met的调控机制可能包括:1)HGF配体激活表达;2)c-Met基因扩增引起过度表达;3)c-Met基因突变引起过度表达。这些变化往往会导致c-Met激酶信号通路的持续过度激活,甚至对配体的结合也变得过度敏感,进而引起细胞自发的持续增殖和癌症的进一步发展。
近年来最受关注的c-Met基因突变类型是外显子14缺失突变。c-Met基因外显子14位于蛋白近膜区域,与c-Met内吞和降解密切相关。由此可见,如果缺失了外显子14片段,c-Met功能的内吞和降解会受到严重损失,带来信号通路持续激活。
c-Met基因外显子14缺失突变最早被发现于非小细胞肺癌(NSCLC)中,相关研究也比较充分。统计显示,该突变在肺腺癌中的发生率约为3%,在肺腺鳞癌中的发生率约为5%,在化疗耐药的肺肉瘤癌中则高达32%。有临床研究显示,对于包含c-Met基因外显子14缺失突变的肺腺癌患者,靶向抑制c-Met的策略已经展现出积极的临床效果。越来越多的研究使得c-Met在NSCLC领域中正逐渐上升为与EGFR和ALK一样重要的治疗靶点。
小分子c-Met靶向药物:从多激酶抑制剂到具有高选择性的单一激酶抑制剂
靶向c-Met的在研新药不在少数。根据医药魔方NextPharma数据库,以c-Met为靶点,可以检索到包括大分子和小分子在研药物共计78项。不过目前已经上市的c-Met靶向药物并不多。FDA目前只批准了两款对包括c-Met在内的多种激酶都具有抑制效果的小分子药物,大分子则还没有c-Met靶向药物获批上市。
后续还有一些在研的特异性靶向c-Met靶点的小分子TKI,包括诺华的卡马替尼(capmatinib,INC280)。今年2月,FDA受理了卡马替尼的新药上市申请(NDA),并授予优先审评资格。由于FDA向一项NDA授出优先审评资格的条件是要求其在临床试验中展示出了优于当前现有疗法的数据,这也说明有足够证据显示特异性抑制c-Met信号通路相比标准疗法能够显著改善这类患者的治疗效果,而卡马替尼背后的科学机制也受到主流市场监管机构的重视。如果卡马替尼获批,也将为全球其他c-Met抑制剂的开发增强信心。
中国也有若干在研的多靶点或单靶点c-Met抑制剂,不过大分子类的c-Met特异性抑制剂项目目前仍是凤毛麟角。
HLX55单抗:从阻断到降解,双机制抑制c-Met通路
作为细胞膜表面的靶点,c-Met为抗体类药物开发提供了机会。靶向c-Met的单抗药物选择性强,安全性优势也比较明显。此外,大分子药物半衰期较长,用药频率较低,患者用药依从性较好。
目前全球尚无靶向c-Met的大分子药物获批上市,在研大分子c-Met抑制剂多数都是单抗药物,也有个别是抗体偶联药物和双抗。目前国内公司获批进入临床的大分子c-Met抑制剂包括复宏汉霖的HLX55和恒瑞的SHR-A1403。复宏汉霖的HLX55在临床前体外和动物模型中均显示出抗肿瘤作用和良好的安全性,为后续开展人体临床试验提供了科学基础。HLX55已于2019年9月和10月相继获得台湾TFDA和中国大陆NMPA的临床试验批准。近日,HLX55针对晚期实体瘤的临床I期研究已经在中国台湾完成首例患者给药。
HLX55是一种人源化IgG2。有意思的是,作为单抗类药物,HLX55可以高效特异阻断c-Met与配体的结合之外,还有一项独特的优势:可以同时诱导c-Met内吞和降解。通过这样的双重作用机制,增强了对c-Met信号通路的抑制作用,从而有望展现出更强的抗肿瘤作用效果。
正如此前提到,外显子14在正常生理状态下,对于诱导c-Met降解并下调c-Met通路信号至关重要,外显子14的缺失正是c-Met通路过度活化的重要原因。HLX55的临床前数据显示,即使是在c-Met基因外显子14缺失的肺癌细胞系中,HLX55依然可以成功诱导目标蛋白降解,对于c-Met基因外显子14缺失突变引起的耐药群体,HLX55这个特征在临床上可能有着更为重要的意义。
综合来看,HLX55作为一款靶向c-Met的创新单抗药物,未来有望为c-Met异常活化相关的肿瘤患者人群带来更为精准高效的治疗选择,对于复宏汉霖则有着深入积累对c-Met相关信号通路的了解与数据、进一步丰富抗肿瘤产品管线布局、增加管线覆盖瘤种的战略意义。c-Met突变的主要癌种,包括肺癌、结直肠癌和胃癌,均是其高度关注的适应症。另外也值得注意的是,HLX55在动物模型实验中,即使微小剂量(0.1mg/kg)也能对人胶质母细胞瘤产生较好的抑制作用(见下图)。HLX55的推进,势必能够进一步加强复宏汉霖在这些领域的竞争优势与市场地位。
不同剂量HLX55在人胶质母细胞瘤异种移植模型中对肿瘤的抑制作用
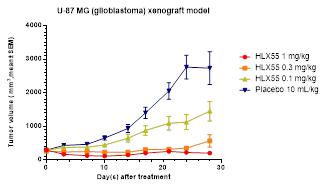
HLX55联合用药与相关双抗未来可期
除了单独用药,c-Met抑制剂与其他抗肿瘤药物联用的潜力也在受到越来越多的关注,研究较多的是EGFR抑制剂。
c-Met突变在肺癌中被研究得较为充分,是引起EGFR TKI耐药的重要原因。包括当红明星,三代EGFR TKI奥希替尼耐药,除了熟知的C797S突变外,c-Met基因突变扩增同样是耐药的主要原因。国际国内的多项临床研究曾显示,EGFR抑制剂和c-Met抑制剂联用,临床上显示出很好的治疗效果。吴一龙教授就曾在2018年ESMO报道,c-Met抑制剂联合EGFR抑制剂吉非替尼,对既往EGFR-TKI耐药的c-Met突变EGFR阳性非小细胞肺癌患者能够取得较好的治疗效果。这些结果也为未来HLX55适用场景的进一步拓展提供了想象空间。
此外,c-Met通路异常作为一些肿瘤发生和出现耐药的驱动因素,其抑制剂与靶向PD-1等肿瘤免疫治疗相关靶点的药物以及抗血管生成相关靶点的药物可能存在较好的互补协同作用。若未来有联合用药的探索,则可以同时针对肿瘤发生和发展的“内因”以及肿瘤微环境“外因”双管齐下,是一个值得关注的方向。
不仅如此,HLX55潜在的联合用药可能,对于复宏汉霖这样Pipeline和肿瘤治疗的靶点布局都已经十分完备的创新型药企,毫无疑问意味着更多的协同机会,这也与复宏汉霖一直着力推进的“Global+Combo”联合治疗战略相吻合。复宏汉霖已经拥有HLX07 (EGFR),完全可以探索EGFR+c-Met的自有单抗组合联用。此外,包括具有抗血管生成作用的HLX04(VEGF),以及肿瘤免疫检查点抑制剂HLX10 (PD-1) 、HLX20(PD-L1) 等在研品种,也有机会尝试与HLX55的联合用药。考虑到c-Met抑制在胃癌治疗上的潜力,HLX55与HLX22(新型抗HER2单抗)的联合也许能够为胃癌的治疗带来崭新的思路。由于自有产品线丰富,开展联合用药研究所需的沟通成本、实际可执行性等方面都具有较大的优势。
除了联合用药,HLX55作为抗c-Met单抗,其开发过程无疑能够为复宏汉霖积累丰富的c-Met抗体与受体相互作用、药效结构等方面的数据与经验,在此基础上再依托复宏汉霖在肿瘤免疫和抗血管生成相关靶点的抗体研发经验,以及已经建立起的完善的双特异性抗体研发平台,有理由期待c-Met/PD-1、c-Met/EGFR等靶点组合的双特异性抗体是一个值得进一步期待与评估的方向,有望显著提升复宏汉霖现有Pipeline的价值和市场机会。
国内外也有若干c-Met/PD-1、c-Met/EGFR双抗在早期研究中取得了积极数据,为这一方向的可行性积累了更多证据[3-6]。例如,罗氏的一项早期研究结果显示,其研发的c-Met/EGFR双抗(MetHer1)在HGF高表达的NSCLC异种移植小鼠模型中展示出了强效的抗肿瘤效果,且对人前列腺癌细胞系迁移及侵袭的抑制效果强于抗c-Met单抗与抗EGFR单抗联合给药的抑制效果[4]。
另外一款强生在研的c-Met/EGFR双抗(JNJ-61186372)也对c-Met或/和EGFR驱动的NSCLC肿瘤模型展现出了较好的抑制效果,且在食蟹猴体内研究中未观察到重大毒性[6]。国内的一项研究显示c-Met/PD-1双抗在体外实验中能够有效抑制c-Met和PD-L1均高表达的胃癌细胞和肺癌细胞的生长、迁移和抗凋亡作用[3]。
参考文献:
[1] Paolo M. Comoglio, Silvia Giordano andLivio Trusolino. Drug development of MET inhibitors: targeting oncogeneaddiction and expedience. doi: 10.1038/nrd2530.
[2] Comoglio PM, Trusolino L, Boccaccio C.Known and novel roles of the MET oncogene in cancer: a coherent approach totargeted therapy. doi: 10.1038/s41568-018-0002-y.
[3] Zu-Jun Sun, Yi Wu, Wei-Hua Hou,Yu-Xiong Wang, Qing-Yun Yuan, Hui-Jie Wang and Min Yu. A novel bispecific c-MET/PD-1antibody with therapeutic potential in solid cancer. doi:10.18632/oncotarget.16173.
[4]Castoldi R, Ecker V, Wiehle L, Majety M,Busl-Schuller R, Asmussen M, Nopora A, Jucknischke U, Osl F, Kobold S, ScheuerW, Venturi M, Klein C, Niederfellner G, Sustmann C. A novel bispecific EGFR/Metantibody blocks tumor-promoting phenotypic effects induced by resistance toEGFR inhibition and has potent antitumor activity. Oncogene. 2013; 32:5593-601.
[5]Bok-Soon Lee, Haeng-Jun Kim, Jae-WoongHwang, Kwang Ho Cheong, Kyung-Ah Kim, Hyun-Young Cha, Ji Min Lee, Chul-Ho Kim.The dual inhibition of Met and EGFR by ME22S, a novel Met/EGFR bispecificmonoclonal antibody, suppresses the proliferation and invasion of laryngealcancer. Ann Surg Oncol. 2016, 23:2046-53.
[6] Moores SL, Chiu ML, Bushey BS,Chevalier K, Luistro L, Dorn K, Brezski RJ, Haytko P, Kelly T, Wu SJ, MartinPL, Neijssen J, Parren PW, et al. A Novel Bispecific Antibody Targeting EGFRand cMet Is Effective against EGFR Inhibitor-Resistant Lung Tumors. Cancer Res.2016;76:3942–53.
