【首部中国生物类似药专家共识出炉,临床应用将有章可循】。
生物药因其明确的疗效优势而畅销全球,然而生物药动辄高昂的价格,又让患者不堪重负。生物类似药的上市打破了生物药市场垄断的格局,通过有效的竞争明显的降低了患者支付负担。但中国医疗专业人士、患者及公众对生物类似药的概念仍然很陌生。
今日上午,由中国临床肿瘤学会(CSCO)中国抗淋巴瘤联盟主办的中国生物类似药专家共识发布会成功举行,北京大学肿瘤医院朱军教授、上海交通大学附属瑞金医院沈志祥教授、哈尔滨血液病肿瘤研究所所长马军教授与中国医学科学院肿瘤医院石远凯教授担任本次会议主席。会上正式发布了首部《中国生物类似药专家共识》(以下简称《共识》),以规范我国生物类似药的临床用药,帮助正确认识生物类似药这一新兴的概念。
《共识》主要包含五方面的内容:生物类似药概述、生物类似药的有效性、生物类似药的安全性、生物类似药的转换、生物类似药的可及性。会议期间北京大学肿瘤医院宋玉琴教授对《共识》进行了深度解读。《共识》中有哪些重点内容?让我们一睹为快!
《共识》促成三大核心
指导生物类似药的临床使用
▍ 生物类似药与参照药高度相似,二者差异性被严格控制
生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品[1]。具有四个重要特征:与参照药高度相似,与参照药的临床意义相同,生物类似药的差异性被严格限制,生物类似药的质量、安全性和有效性有严格标准[2,3]。由于生物药的自然变异性和复杂的生产工艺,导致生物类似药与参照药只能做到高度相似[1,2],两者的允许差异范围与参照药批次间允许的差异范围相同(图1)。
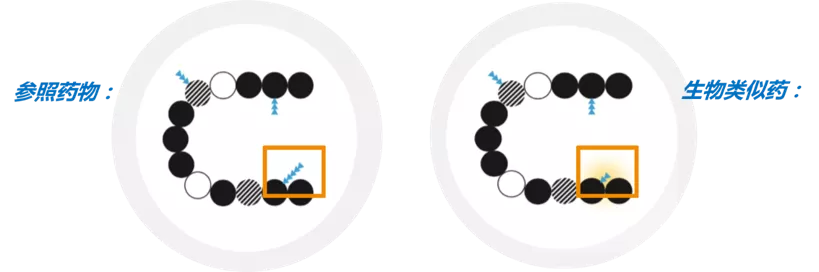
图1. 生物类似药和参照药之间的差异性(黄色阴影)
允许糖基化(蓝色小三角形表示)方面的差异,但蛋白质氨基酸序列(圆圈)一致
▍生物类似药火热朝天,汉利康成为中国首个获批的生物类似药
随着越来越多的原研生物药专利到期,全球生物类似药呈现出热火朝天的发展景象。根据Clarivate Analytics Cortellis数据库,截至2019年5月29日[4],全球处于活跃状态的生物类似药共718个,其中,单克隆抗体占整个生物类似药的52.4%。生物类似药的开发主要集中在肿瘤、免疫以及血液疾病,这三大领域研发数量占56%。截至2020年3月,欧盟已批准65个生物类似药[5],美国食品药品监督管理局(FDA)批准26个生物类似药[6]。
中国有27个生物类似药处于研发状态,约有一半处于临床前研究阶段,有10个已获得临床批件。截至2019年12月,我国共有4个生物类似药获批上市,其中复星医药生物药平台复宏汉霖研发生产的利妥昔单抗注射液汉利康(HLX01)于2019年2月22日获批上市,是我国首个获批上市的生物类似药[7]。
由复星医药生物药平台复宏汉霖研发生产的阿达木单抗生物类似药HLX03的上市申请正在受理中,2019年的欧洲抗风湿联盟(EULAR)会议公布了阿达木单抗生物类似药HLX03与参照药阿达木单抗的I期试验结果。这项随机、双盲、单剂量、平行比较研究证实了HLX03和阿达木单抗在PK方面具有生物等效性。HLX03与阿达木单抗的Cmax、AUClast的几何均数比值的双侧90%CI在80%-125%范围内。组间AUC0-inf几何均数比值的双侧90%CI也在等效范围内,进一步证实了两种药物的PK生物等效性。另外,该项研究证实二者在安全性和免疫原性也具有相似性。
▍生物类似药与参照药疗效等同、安全性相似,可替代使用和转换
目前资料表明生物类似药在临床试验或临床使用中与参照药疗效相似。例如,汉利康的3期随机双盲对照“头对头”临床试验中,汉利康与参照药的客观缓解率(ORR)组间差异为1.4%,符合国家药品审评中心(CDE)规定的±12%等效性界值区间,表明汉利康与参照药具有临床等效性[8]。两项分别纳入了1534例患者[9]与3163例患者[10]的Meta分析证实,已上市利妥昔单抗生物类似药与参照药临床等效。
过去十年,在欧盟的安全监控系统中尚未发现生物类似药与参照药之间存在不良反应性质、严重程度或发生频率的差别。相关上市前和上市后研究显示,生物类似药的安全性与其参照药类似[11],且生物类似药在外推适应症中使用的安全性与参照药类似 [12,13]。因此,生物类似药在安全性方面,包括不良事件的发生率、免疫原性及外推适应症等,与参照药相似,可以被安全地用于临床实践。
而药物转换是指由处方医生决定将一种药物转换为另一种治疗用途相同的药物。目前临床医师对生物类似药的转换主要有生物类似药和参照药之间的转换、生物类似药之间的转换两方面,其中生物类似药与参照药之间的转换较多见。相关研究表明从参照药转换到对应的生物类似药不会产生任何新的安全性事件[14]。基于国内国家药品监督管理局(NMPA)对临床转换暂无具体规定,参考国外其他国家的规定,建议主要由临床医生根据临床实际决定,但需要与患者做好知情协商。
最后,宋玉琴教授强调,生物类似药的出现可以说大大提高了患者用药的可及性。生物类似药以低于其参照药物的价格推向市场,在增加市场竞争的同时,可以降低复杂医疗条件下的总体护理成本[15],生物类似药的发展有助于为患者和社会带来真正的价值。
鉴于生物类似药所表现出的与参照药的高度相似性,该《共识》最终达成了三个核心共识(图2)以指导生物类似药的临床使用。

图2. 《共识》达成的三个核心共识
那么,《共识》对未来临床工作有哪些积极意义?会上多位专家对该议题进行了热烈的讨论。
南京医科大学第一附属医院徐卫教授:大规模临床试验及真实世界数据显示汉利康与其参照药疗效等同,安全性相似,可以安全的用于临床实践。《共识》的发布有助于推动中国生物类似药的发展、提高患者生活质量、并降低医保费用。
复旦大学附属肿瘤医院李小秋教授:祝贺《共识》的成功发布,希望复星医药更多造福国内外淋巴瘤及有需要的患者。
江西省肿瘤医院双跃荣教授:《共识》的发布对临床医生非常有指导意义,宋教授的精彩解读也解决了很多临床医生关于生物类似药的适应症外推和转换的疑惑。有了《共识》作为指导,医生可以更放心地在临床实践中使用生物类似药,并根据患者情况进行药物转换。生物类似药的发展使患者有更大的可及性和获益。
河北医科大学第四医院刘丽宏教授:通过本次发布会学习到生物类似药与参照药疗效相同、免疫原性相同、安全性相似,并可以外推到其他适应症。药物可相互转换使得临床医生可以根据患者情况决定使用参照药还是生物类似药。生物类似药的上市有助于市场发展,降低医保费用,使更多患者获得使用药物的权利。
山西省肿瘤医院苏丽萍教授:汉利康是中国首个上市的生物类似药,其与参照药头对头的临床研究提供了最大的证据级别,它与原研药具有一样的品质,相互转换没有任何影响。汉利康是领域内里程碑似的发展,临床医生有责任推动汉利康的临床应用,推动国家在生物类似药领域的发展。
中国医科大学附属盛京医院刘卓刚教授:《共识》的发布让临床医生在使用生物类似药时有更好的依据,生物类似药药优价低,能让患者获得更大获益。汉利康的出口亦证明了我国在药物研发上的进步。
吉林大学白求恩第一医院白鸥教授:临床研究和真实应用证明汉利康疗效肯定、安全性可靠。其在适应症上可外推,也可与参照药和其他生物类似药转化。汉利康为我国生产,成本低,具有价格优势,患者获益更高、可及性更好,也使得临床上有了更多的选择,临床医生有责任推动生物类似药的推广。临床上需要这样的《共识》,使得医生有据可循,且能更有信心、有把握地使用生物类似药。
宋玉琴教授:汉利康的上市推动了《共识》的制定和发布,《共识》的发布会在未来的临床工作上给予指导,对患者、我国医保系统降低成本非常有意义。
热度持续发酵,《共识》发布会后复星淋巴血液最新进展高峰会又将会场气氛带入新的高潮。
B细胞淋巴瘤治疗,
利妥昔单抗的地位不可取代
首先中山大学附属肿瘤医院淋巴瘤治疗研究中心黄慧强教授带来《2020年B细胞淋巴瘤领域MVP(the Most Valuable Progress)盘点》。
淋巴瘤是一种起源于淋巴造血系统的恶性肿瘤,流行病学显示其发病率约为6.9/10万,5年患病人数约157.6万。67%的淋巴瘤为B细胞淋巴瘤。当前,B细胞淋巴瘤的临床治疗仍面临年老体弱者无耐受药物、部分难治/复发患者无有效治疗方案、早期复发患者预后差及疾病异质性强、临床缺少有效的预后模型等痛点。抗体靶向类药物、小分子靶向药物及细胞免疫治疗等新药的出现为解决B细胞淋巴癌临床痛点带来希望。
目前B细胞淋巴瘤的治疗仍以CD20单抗为主,其中利妥昔单抗在联合化疗或者联合新药中的地位不可取代,利妥昔单抗与新药的联合为部分复发/难治患者带来希望。以伊布替尼为主的小分子靶向抑制剂为慢性淋巴细胞白血病(CLL)患者带来较深的缓解,也预示着利妥昔单抗联合来那度胺治疗的无化疗时代的到来。细胞免疫疗法是难治性淋巴瘤患者的希望,但仍需更多研究规避此疗法带来的毒副反应。
剑指血小板减少症,
新一代TPO-RA阿伐曲泊帕国内获批
山东大学齐鲁医院侯明教授带来《新型TPO-RA在血液领域应用研究进展》。
血液系统血小板减少症(TCP)发生率较高,新型血小板生成素受体激动剂(TPO-RA)在血液病领域的应用前景广阔。2020年4月15日,NMPA批准阿伐曲泊帕(苏可欣)用于择期行诊断性操作或者手术的慢性肝病相关血小板减少症的治疗,是目前获批的最新一代TPO-RA。阿伐曲泊帕可强效快速升血小板,口服方便,不受饮食限制,为血小板减少症患者带来获益。新型TPO-RAs在免疫性血小板减少症(ITP)领域的应用已得到国内外指南的一致推荐,可作为二线治疗的优选。
靶向难治侵袭性淋巴瘤患者,
中国首个自体CAR-T细胞治疗产品有望落地
北京大学肿瘤医院应志涛教授带来《CAR T细胞治疗在淋巴瘤中的应用价值及存在问题》。
近年来,嵌合抗原受体T细胞免疫疗法(CAR-T)在急性淋巴细胞白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。
ZUMA-1研究是一项探究Axi-Cel(CAR-T细胞治疗产品)治疗耐药、侵袭性B细胞非霍奇金淋巴瘤(NHL)的疗效与安全性的单臂、多中心I~II期关键临床研究。ZUMA-1研究结果显示,患者ORR为83%,完全缓解率为58%。ZUMA-1长期随访(中位随访27.1个月)结果显示,93%的在12个月时持续缓解的患者,在24个月时仍处于缓解中,药物疗效持久性佳[16]。
2020年2月,Axi-Cel落地国内的CAR-T细胞治疗产品FKC876的药品上市注册审评获受理,将用于成人复发难治性大B细胞淋巴瘤治疗。中国境内尚无与该产品具有相同靶点的同类药物获批上市。FKC876有望为中国难治侵袭性淋巴瘤患者带来新生的希望。
附:CSCO生物类似药专家共识专家组成员:
参考文献
[1] 《生物类似药研发与评价技术指导原则(试行)》.国家食品药品监督管理总局(2015)
[2] Biosimilars in the EU(Information guide for healthcare professionals), European Medicines Agency and the European Commission(2019).
[3] 2015《中国药典》三部
[4] Clarivate Analytics Cortellis (数据截至2019.05.29)
[5] Biosimilars in the EU © European Medicines Agency;www.ema.europa.eu
[6]https://www.fda.gov/drugs/biosimilars/biosimilar-product-information
[7] http://www.nmpa.gov.cn
[8] Yuankai Shi, et al. First China Approved Rituximab Biosimilar HLX01: Pharmacokinetics, Safety and Efficacy Comparison to Reference Rituximab in the Phase 3 Diffuse Large B-Cell Lymphoma Study, 2019, ASH, oral abstract 2878.
[9] Yang J, Yu S, Yang Z, et al. Efficacy and Safety of Anti-cancer Biosimilars Compared to Reference Biologics in Oncology: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. BioDrugs. 2019;33(4):357-371.
[10] Lee S, Lee H, Kim E, Comparative Efficacy and Safety of Biosimilar Rituximab and Originator Rituximab in Rheumatoid Arthritis and Non-Hodgkin's Lymphoma: A Systematic Review and Meta-analysis. BioDrugs 2019;33(5): 469-483.
[11] Braun J, Kay J. The safety of emerging biosimilar drugs for the treatment of rheumatoid arthritis. Expert Opin Drug Saf. 2017;16(3):289–302.
[12] Park SH, Kim YH, Lee JH, et al. Post-marketing study of biosimilar infliximab (CT-P13) to evaluate its safety and efficacy in Korea. Expert Rev Gastroenterol Hepatol. 2015;9(suppl 1):35-44.
[13] Fiorino G, Manetti N, Variola A, et al. Prospective observational study on inflammatory bowel disease patients treated with infliximab biosimilars: preliminary results of the PROSIT-BIO cohort of the IG-IBD. J Crohns Colitis 2016; 10(suppl 1): S376-S377.
[14] Griffiths CEM, et al. The EGALITY study: a confirmatory, randomized, double-blind study comparing the efficacy, safety and immunogenicity of GP2015, a proposed etanercept biosimilar, vs. the originator product in patients with moderate-to-severe chronic plaque-type psoriasis. Br J Dermatol. 2017;176(4): 928-938.
[15] Aladul MI, Fitzpatrick RW, Chapman SR. The effect of new biosimilars in rheumatology and gastroenterology specialities on UK healthcare budgets: Results of a budget impact analysis. Res Social Adm Pharm. 2019;15(3):310-317.
[16] Frederick L Locke, et al. Long-term safety and activity of axicabtagene ciloleucel in refractory large B-cell lymphoma (ZUMA-1): a single-arm, multicentre, phase 1-2 trial. Lancet Oncol. 2019; 20(1): 31-42.





