双抗的“双特异性”可通过重链可变区单域抗体(VHH)或单链可变区(scFv)的组合来实现。复宏汉霖已成功建立了超大库容人源化羊驼VHH噬菌体展示库以及高效的scFv构建平台,正在积极推进20项基于VHH或scFv的新型抗体/融合蛋白项目在临床前的研发。其中,双特异性抗体HLX301(包含TIGIT靶点的双特异性抗体)与HLX35(包含4-1BB靶点的双特异性抗体)已完成了初步的临床前研究并递交了相关的中国与国际专利申请,更多的新型抗体项目也将在近期迎来关键进展。
在肿瘤治疗领域,通过不同靶点的选择与组合,双抗可带来令人惊喜的效果,包括(1)招募更多功能性免疫细胞靶向地杀伤或抑制肿瘤细胞;(2)可以同时作用于具有协同作用的信号通路;(3)通过增强靶向特异性能够降低所需用药剂量,减少脱靶毒性;(4)若双抗的两个表位为同靶点的不同表位,则可以增强作用效果并有效地防止耐药发生。
VHH与scFv——双特异性抗体的构建基础
在传统单克隆抗体的基础上,随着抗体工程等生物技术的不断发展以及成药靶点的逐渐积累,抗体药物可能的结构与功能出现了前所未有的多样性。双特异性抗体(Bispecific antibody, BsAb),一般简称“双抗”,是近年来最受关注、进展最快、应用前景最好的新型抗体之一。与单抗只能识别一个抗原表位不同,双抗能够与两个不同靶点或者与同一靶点的两个不同抗原表位相结合,由此能够作用于两个信号传导途径或加强对同一信号传导途径的作用。
双抗在肿瘤免疫治疗领域的潜力尤其值得关注。例如双抗可同时靶向肿瘤细胞表面的特异性靶点(如CD20、CD38、c-MET等)与T细胞等免疫细胞表面的靶点(如PD-1、4-1BB、TIGIT)。肿瘤特异性靶点往往在肿瘤的生长与转移中起重要作用,通过与肿瘤特异性靶点的结合,双特异性抗体能够发挥抑制肿瘤生长与迁移的作用;同时通过与免疫细胞表面靶点的结合,又能够发挥调节肿瘤免疫反应的作用,以抑制肿瘤免疫逃逸或增强免疫反应;具有Fc端的双特异性抗体还可通过与免疫细胞表面Fc受体的相互作用诱导免疫细胞对肿瘤的吞噬或细胞毒作用,杀伤肿瘤细胞。
在空间上,由于双特异性抗体与肿瘤特异性靶点的结合,使得另一靶点带来的免疫调节作用也主要发生在肿瘤组织周围,能够增强免疫调节的作用效果,减少免疫调节对正常组织造成的毒副作用,即脱靶毒性,这一作用特征是目前的联合疗法所无法实现的。
靶点组合确立后,在双抗的设计中,针对两个目标靶点分别构建具有良好特异性的结合区域是保证双抗能够具备理想作用效果的关键。针对这一挑战,两种抗体结构单元--单链可变区(scFv)与重链可变区单域抗体(VHH)能够发挥核心作用,成为双抗构建中的“基石”。
抗体的结构具有模块化的特征,不同的模块之间在结构与功能上都相对独立。抗体与靶点进行特异性识别与结合的模块为抗体Fab端的可变区。一个完整的Fab端可变区被称为单链可变区(scFv),包含一个重链可变区与一个轻链可变区。其中重链可变区在与靶点的识别与结合中起到主要作用,单个重链可变区构成的单域抗体即VHH。VHH与scFv都能独立承担识别靶点、结合靶点的任务,因此双抗的“双特异性”可通过VHH或scFv的组合来实现。围绕VHH与scFv的构建技术,复宏汉霖研发团队进行了重点攻关,已成功建立了超大库容(2×1012)人源化羊驼VHH噬菌体展示库以及高效的scFv构建平台。
复宏汉霖基于VHH的新型抗体研发进展
复宏汉霖VHH噬菌体展示库骨架区已大部分置换成人类序列,同时也保留了FW2区域小部分原有的亲水性氨基酸,既实现了抗体的高度人源化又保留了羊驼单域抗体原有的亲水性优势。同时高达80%以上的克隆具有完整的开放阅读框(Open Reading Frame),保证了从库中筛选出的VHH基因片段能够正常表达对应的VHH结构。利用这个VHH噬菌体展示库进行特定靶点的VHH结构筛选,无需通过传统的免疫动物的方法,也无需人源化改造或亲和力成熟等复杂过程,显著提高了筛选效率。对于大部分目标靶点,复宏汉霖研发团队均能够从VHH噬菌体展示库中快速筛选出具有高亲和力的VHH结构,进一步组成双特异性抗体以及其他新型抗体或者融合蛋白。
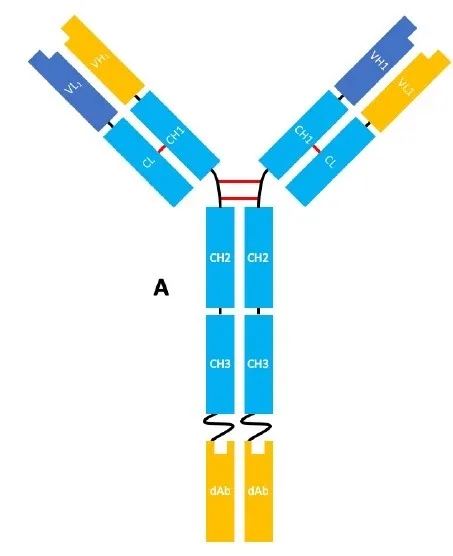
基于VHH的双抗结构示例[1]
利用这一强大的VHH噬菌体展示库,复宏汉霖已开展8项基于VHH的新型抗体/融合蛋白项目,目前均处于临床前研发阶段。其中HLX301为包含TIGIT靶点的双特异性抗体,其TIGIT结合域即来源于VHH噬菌体展示库筛选出的对TIGIT具有高亲和力、高特异性的VHH片段。TIGIT在肿瘤浸润T细胞表面有丰富的表达,属于肿瘤免疫检查点蛋白,能够抑制效应T细胞对肿瘤的杀伤,亦能增强调节T细胞对肿瘤免疫反应的抑制。未来,围绕TIGIT靶点的创新研发有望极大丰富肿瘤免疫治疗的选择。
复宏汉霖基于scFv的新型抗体研发进展
复宏汉霖强大灵活的scFv构建平台主要得益于多年铸成的单抗发现及抗体工程改造能力。另外,在打造当前深厚、靶点覆盖广泛的单抗产品管线的同时,复宏汉霖自然而然地围绕相关信号传导通路积累了许多药效结构等方面的数据与经验,也为scFv构建平台奠定了基础。目前,复宏汉霖正在积极推进12项基于scFv的新型抗体/融合蛋白项目,这些项目目前处于临床前研发的不同阶段。
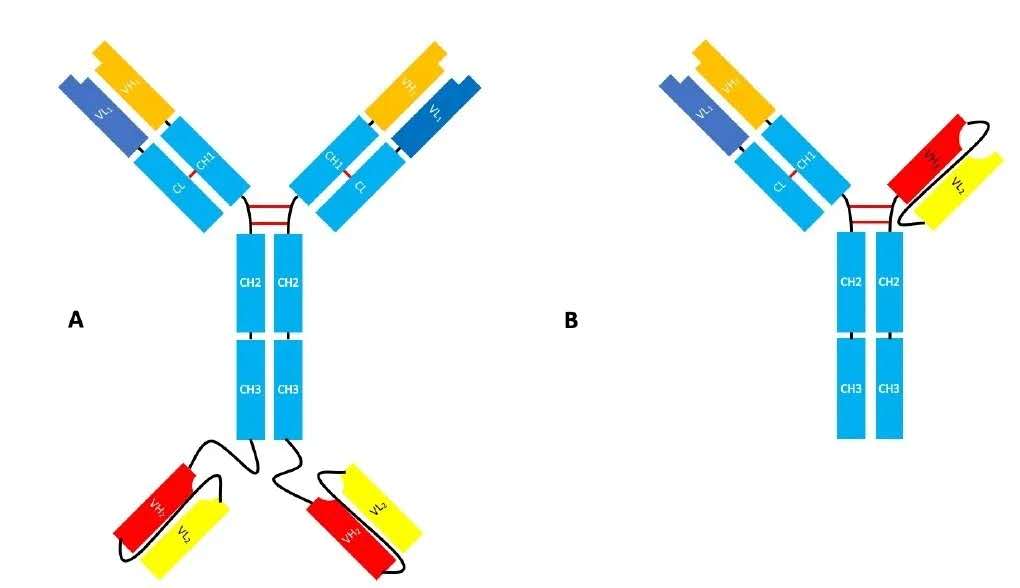
基于scFv的双抗结构示例[1]
HLX35为包含4-1BB(CD137)靶点的双特异性抗体,4-1BB主要表达于活化的T细胞和NK细胞表面,是T细胞协同刺激分子。HLX35的4-1BB结合域来源于抗 4-1BB单克隆抗体的scFv片段,与4-1BB特异性结合后能够产生T细胞协同刺激信号。研究表明,4-1BB能够增强T细胞的效应能力与细胞因子的分泌,延缓T细胞凋亡,同时能够增强自然杀伤(NK)细胞的细胞毒性作用[2]。
复宏汉霖已完成了HLX301与HLX35初步的临床前体外及体内研究以及细胞株开发,正在进行进一步的临床前评估,有望在2021年递交相关临床试验申请,复宏汉霖也已递交相关中国与国际专利的申请,并已获得相关抗TIGIT单域抗体的中国专利授权。
未来,复宏汉霖将充分利用多年积累的抗体领域研发经验,尤其是近年来打造的VHH噬菌体展示库与scFv构建技术,加速推进HLX301、HLX35以及后续双特异性抗体和其他新型抗体/融合蛋白的创新研发,其中多款都有成为全球同类首款(first-in-class)的潜力。持续以领先的抗体科学与技术不断寻求为患者带来获益的创新治疗手段。
【参考文献】
1. Bates A, Power CA. David vs. Goliath: the structure, function, and clinical prospects of antibody fragments[J]. Antibodies, 2019, 8(2): 28.
2. Chester C, Sanmamed MF, Wang J, et al. Immunotherapy targeting 4-1BB: mechanistic rationale, clinical results, and future strategies[J]. Blood, 2018, 131(1): 49-57.
