2022年1月4日,复宏汉霖(2696.HK)宣布,公司自主研制的HLX35(重组人源抗EGFR和抗4-1BB双特异性抗体注射液)获国家药监局临床试验申请(IND)批准,拟用于治疗晚期恶性实体瘤。公司计划于近期开展I期临床试验。目前,全球尚无靶向EGFR×4-1BB的双特异性抗体上市,HLX35有望成为first-in-class抗4-1BB×EGFR双抗。
基于临床上在肿瘤发生、进展、治疗等过程中发挥着重要作用的靶点EGFR和4-1BB,复宏汉霖不断探索新的治疗手段,以进一步填补相关治疗领域临床需求。4-1BB又称CD137,是肿瘤坏死因子受体超家族成员,表达于活化的T细胞表面,也可表达于NK细胞、NKT细胞、肥大细胞等。4-1BB释放共刺激信号,激活CD8+T细胞的细胞毒性作用,帮助记忆T细胞的形成。此外,4-1BB信号可以激活NK细胞和树突状细胞,进一步维持细胞毒性T细胞的激活。这些特征使得4-1BB成为增强癌症免疫治疗领域内备受青睐的靶点。绝大多数4-1BB单抗和双抗目前尚处于早期临床或临床前阶段,适应症包括晚期实体瘤、黑色素瘤和非霍奇金淋巴瘤等。部分早期临床研究的结果显示,4-1BB单抗和双抗具有可接受的安全性、耐受性和一定程度的抗肿瘤疗效。EGFR属于受体酪氨酸激酶,在细胞增殖、分化和迁移的过程中发挥重要作用。EGFR的突变和过表达与非小细胞肺癌、结直肠癌、头颈癌、乳腺癌、宫颈癌、膀胱癌、甲状腺癌、胃癌等实体瘤的发生密切相关。抗EGFR单抗目前被批准的适应症主要是EGFR表达阳性的肿瘤,包括联合化疗或放疗或单药治疗非小细胞肺癌、结直肠癌和鳞状细胞癌等。
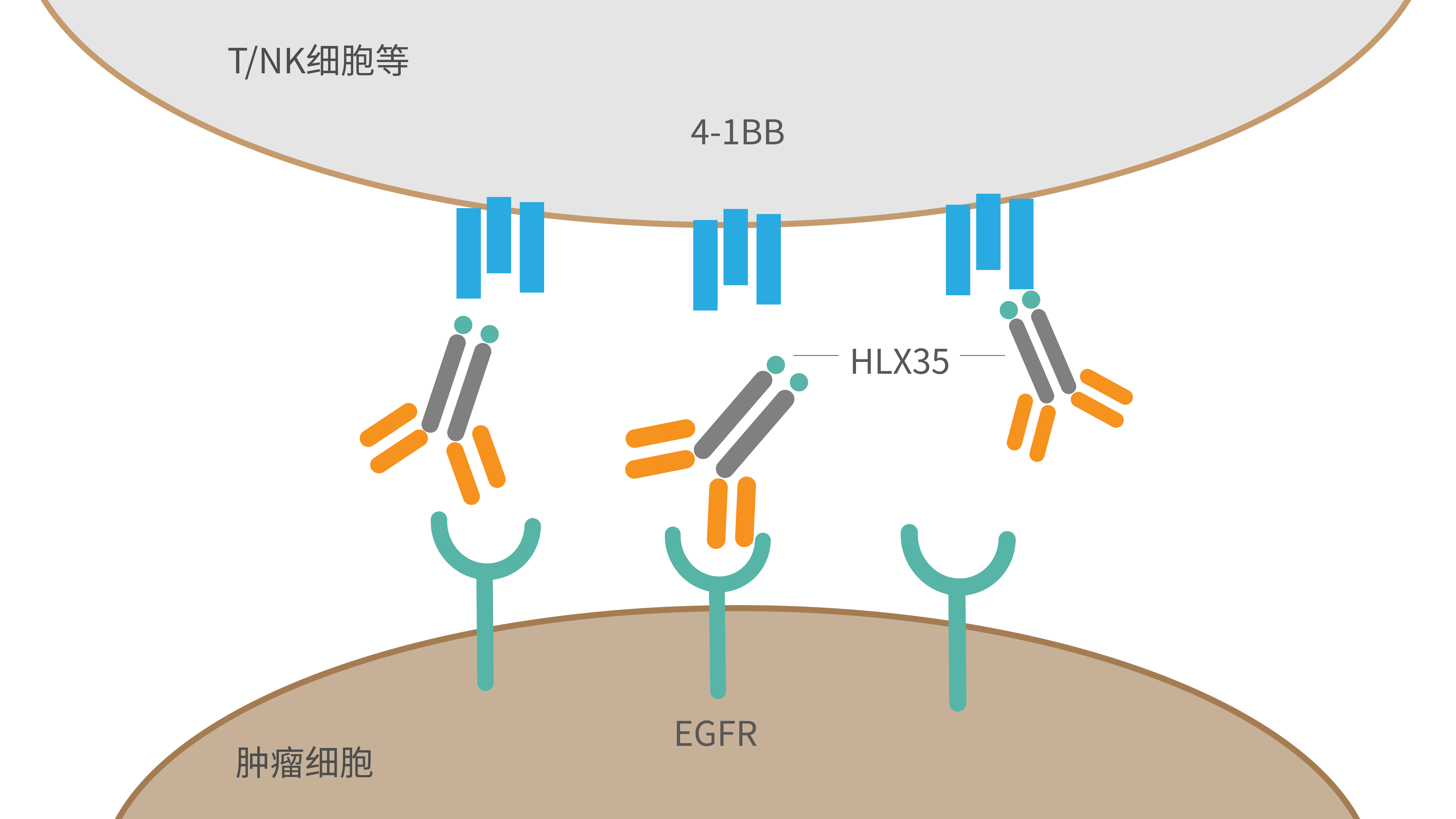
HLX35是公司自主研发的创新型抗EGFR和抗4-1BB双靶点的双特异性抗体。根据临床前研究结果,HLX35显示出比抗4-1BB或抗EGFR单抗的单一或联合治疗都更加优越的肿瘤抑制效果。双特异性抗体药物可有效将两个靶点的优势合并在一起,HLX35可以结合在肿瘤表面的EGFR分子上,阻断EGFR的激活和下游信号通路的磷酸化,杀死肿瘤细胞;同时还可以在EGFR的参与下,结合免疫细胞(T细胞和NK细胞)表面上的4-1BB免疫激活分子,使更多的免疫细胞聚集在肿瘤周围,并刺激微环境中免疫细胞的活性,从而协同杀死肿瘤细胞,提高疗效。2020年11月,公司就HLX35与Binacea pharma Inc. 达成独家许可协议,授予其于除中国(包括港澳台地区)以外的全球范围进行研究、开发、生产和商业化权利。
复宏汉霖从临床需求出发,目前已打造出多元化的创新产品管线,在PD-1/L1、CTLA-4、LAG-3等免疫检查点全面布局,为免疫联合治疗的探索创造更多可能。公司持续丰富创新靶点布局,产品覆盖c-MET、TROP2、TIGIT和BRAF等新兴靶点,并积极开展双特异性抗体、抗体偶联药物(ADC)等产品的开发,同时公司将持续加码创新,加强优质创新资产的引进和合作,“内外兼修”,为全球患者带去高质量、可负担的创新治疗方案。
【参考文献】
[1] Croft M. The role of TNF superfamily members in T-cell function and diseases[J]. Nature Reviews Immunology, 2009, 9(4): 271-285.
[2] Hashimoto K. CD137 as an Attractive T Cell Co-Stimulatory Target in the TNFRSF for Immuno-Oncology Drug Development[J]. Cancers, 2021, 13(10): 2288.
[3] Guo, G., Gong, K., Wohlfeld, B., Hatanpaa, K. J., Zhao, D., and Habib, A. A. (2015). Ligand-independent EGFR signaling. Cancer Res.75, 3436–3441.
[4] Parseghian CM, Napolitano S, Loree JM, Kopetz S. Mechanisms of Innate and Acquired Resistance to Anti-EGFR Therapy: A Review of Current Knowledge with a Focus on Rechallenge Therapies. Clin Cancer Res. 2019;25(23):6899-6908.
