2022年7月6日,复宏汉霖(2696.HK)宣布,公司自主开发的HLX301(重组抗PD-L1与抗TIGIT双特异性抗体)用于局部晚期/转移性实体瘤或淋巴瘤治疗的I/II期临床研究于中国完成首例受试者给药。目前,全球范围内尚无同类靶向PD-1/L1和TIGIT的双特异性抗体获批上市,HLX301有望成为first-in-class抗PD-L1×TIGIT双抗。
含免疫球蛋白和ITIM结构域的T细胞免疫受体(T cell immunoglobulin and ITIM domain,TIGIT)是一种抑制性受体,在淋巴细胞中表达,包括自然杀伤(NK)细胞、活化的CD8+ T和CD4+ T细胞以及Treg(调节性T细胞)等,其重要配体为主要表达于APC(抗原提呈细胞)或肿瘤细胞表面的CD155(脊髓灰质炎病毒受体,PVR)[1-2]。作为免疫检查点蛋白,TIGIT可通过多种作用机制抑制固有和适应性免疫,在肿瘤免疫抑制中的“踩刹车”作用和PD-1/PD-L1类似[3]。
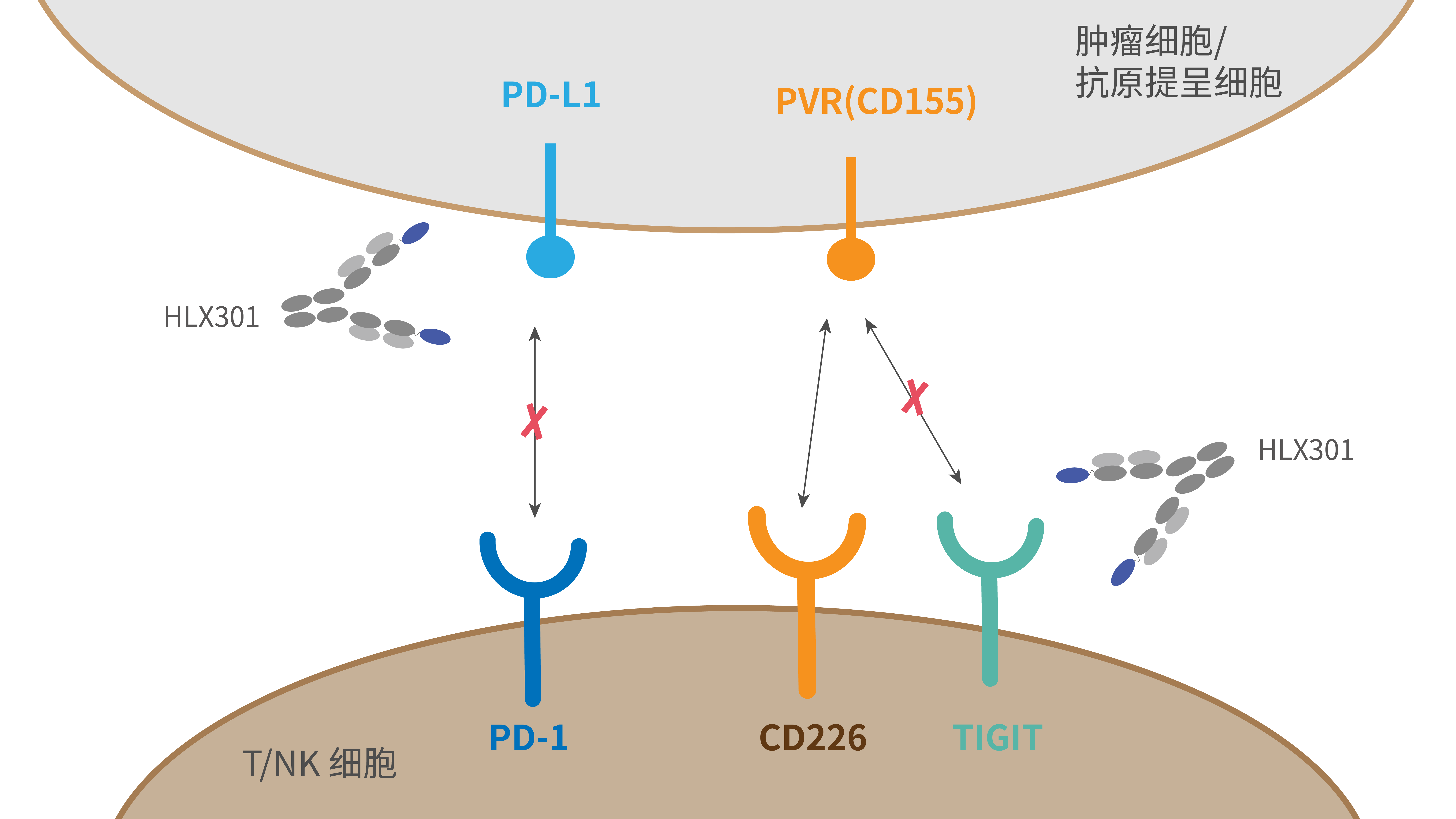
HLX301为复宏汉霖自主开发的创新型抗PD-L1与抗TIGIT双特异性抗体,其TIGIT结合域来源于公司人源化羊驼重链可变区单域抗体(VHH)噬菌体展示库筛选的对TIGIT具有高亲和力、高特异性的VHH,通过重组技术与抗PD-L1单抗组合。HLX301可与PD-L1和TIGIT特异性结合并同时阻断PD-1/PD-L1和TIGIT/PVR负向信号通路,抑制肿瘤细胞的生长,有望用于多种晚期肿瘤的治疗,包括非小细胞肺癌、头颈部鳞状细胞癌、食管鳞癌等。临床前研究结果表明,对比抗PD-L1单抗、抗TIGIT单抗以及两种单抗的联合疗法,HLX301可更有效恢复T细胞受体下游信号,提高抗肿瘤活性,且耐受性、安全性良好,体现出双抗疗法的协同增强效应,为后续临床研究的开展提供了科学基础。2022年2月,HLX301在澳大利亚用于局部晚期或转移性实体瘤治疗的I期临床研究完成首例受试者给药。3月,该产品用于晚期肿瘤治疗的I期临床试验申请获国家药品监督管理局批准。
复宏汉霖不断深耕未满足的临床需求,目前已打造出多元化的创新产品管线,在PD-1/L1、LAG-3、TIGIT、BRAF等创新靶点全面布局,以抗体技术为核心,积极开展双特异性抗体、抗体偶联药物(ADC)、融合蛋白等多种药物形式产品的开发。复宏汉霖将不断提高创新效率,早日为全球患者带来更多高质量、可负担的创新治疗方案。
关于该HLX301 I/II期临床研究
本研究是一项开放标签、多中心的I/II期临床试验,旨在评估HLX301在局部晚期/转移性实体瘤或淋巴瘤患者中的安全性、耐受性、药代动力学及初步抗肿瘤疗效。本研究分为三个部分:Ia期剂量递增阶段、Ib期剂量扩展阶段、II期临床扩展阶段。合格的受试者将接受每两周静脉输注单药HLX301的治疗。Ia期通过贝叶斯最优区间(BOIN)设计,研究HLX301的安全性并确定剂量限制性毒性(DLT)和最大耐受剂量(MTD)。Ib期将进一步评估HLX301的药代动力学、药效动力学特征及初步疗效,以确定II期临床试验推荐剂量(RP2D)。II期研究的主要目的为评估HLX301在局部晚期/转移性实体瘤或淋巴瘤患者中的疗效,主要终点为研究者评估的客观缓解率(ORR)、疾病控制率(DCR)和缓解持续时间(DOR),次要目的为确认HLX301的安全性并评估PD-L1表达水平与HLX301抗肿瘤活性之间的关系。
参考文献
[1] Chauvin JM, Zarour HM. TIGIT in cancer immunotherapy. J Immunother Cancer. 2020;8(2).
[2] Sanchez-Correa B, Valhondo I, Hassouneh F, et al. DNAM-1 and the TIGIT/PVRIG/TACTILE Axis: Novel Immune Checkpoints for Natural Killer Cell-Based Cancer Immunotherapy. Cancers (Basel). 2019;11(6):877.
[3] Yue C, Gao S, Li S, Xing Z, Qian H, Hu Y, Wang W and Hua C (2022) TIGIT as a Promising Therapeutic Target in Autoimmune Diseases. Front. Immunol. 13:911919.
