2022年11月5日至11月12日,第25届全国临床肿瘤学大会暨2022年CSCO学术年会以线上与线下结合的方式召开。11月6日,复宏汉霖创新抗PD-1单抗H药 汉斯状®(斯鲁利单抗)在微卫星高度不稳定(MSI-H)实体瘤的关键性II期临床研究数据更新由浙江省肿瘤医院钟海均教授以口头报告形式在免疫治疗综合专场发布。
此前,H药在食管鳞状细胞癌(ESCC)中开展的关键性III期临床研究数据已于全体大会首次发布并获选优秀论文,由中国医学科学院肿瘤医院黄镜教授进行了口头报告,同步也将于11月12日在食管癌专场由中国医学科学院肿瘤医院宋岩教授进行报告。
以下为H药在MSI-H实体瘤II期临床研究的数据更新详情:
论文题目:Efficacy and safety of serplulimab, a novel anti-PD-1 antibody, in patients with previously treated unresectable or metastatic microsatellite instability-high or mismatch repair-deficient solid tumors: updated results from ASTRUM-010 study
联合主要研究者:秦叔逵,中国人民解放军东部战区总医院秦淮医疗区;李进,同济大学附属东方医院
展示形式:口头报告
主讲人:钟海均,浙江省肿瘤医院
汇报地点:济南会场,免疫治疗综合专场
汇报时间:11月6日 16:10-16:16
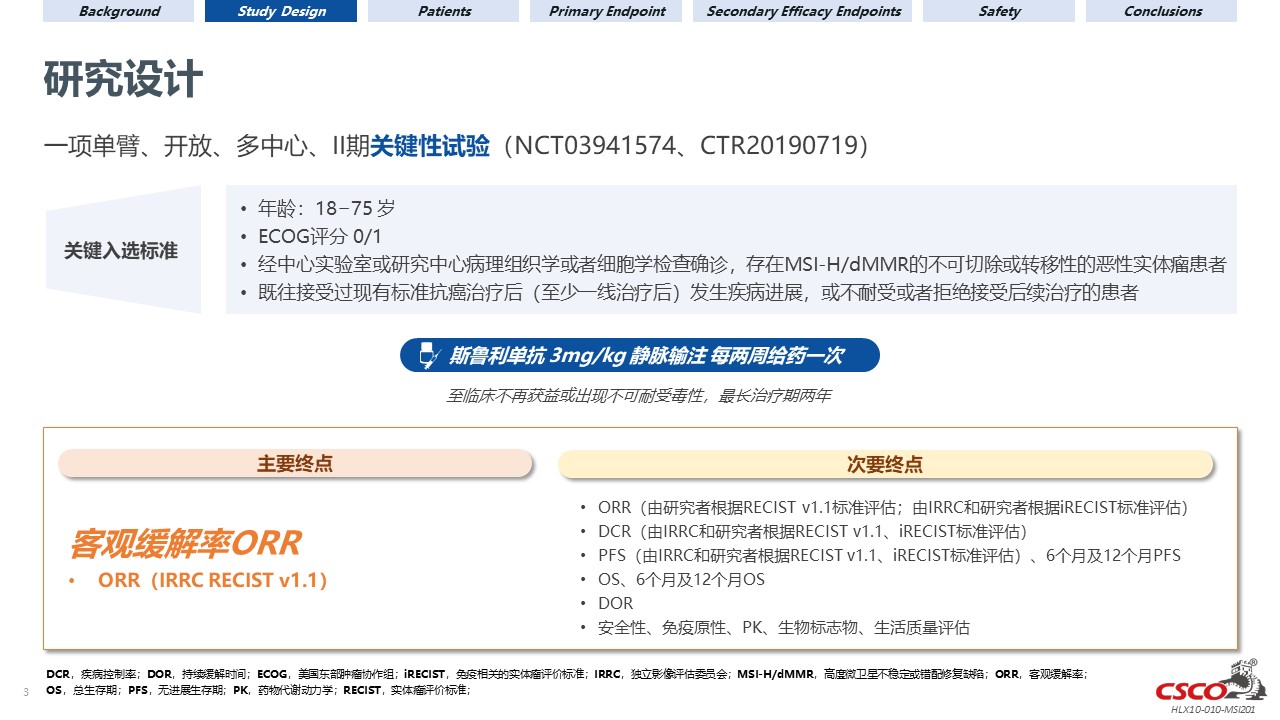
试验设计
此研究是一项在标准治疗失败的、不可切除或转移性高度微卫星不稳定(MSI-H)或错配修复缺陷型实体瘤患者中进行的旨在评价斯鲁利单抗疗效、安全性及耐受性的单臂、开放标签、多中心、II期临床试验。纳入的患者每两周静脉输注3 mg/kg斯鲁利单抗,最多持续两年,或直到疾病进展、出现不可接受的毒性或患者退出。该试验的主要终点为独立影像评估委员会(IRRC)依据RECIST v1.1标准评估的客观缓解率(ORR)。次要终点包括由研究者评估的ORR,以及缓解持续时间(DOR)、无进展生存期(PFS)、总生存期(OS)和安全性。
试验结果
截至2021年7月10日,本试验共入组108名患者并纳入安全性分析集。其中68名经中心实验室或研究中心确认MSI-H的患者被纳入主要疗效分析人群,58名经中心实验室确认MSI-H,且无重大方案偏离的患者被纳入敏感性分析人群。主要疗效分析人群的中位随访时间为13.5个月,敏感性分析人群的中位随访时间为14.0个月。主要疗效分析人群及敏感性分析人群中,经IRRC依据RECIST v1.1评估的ORR分别为39.7%(95% CI 28.0–52.3;3例完全缓解)和43.1%(95% CI 30.2–56.8;2例完全缓解)。
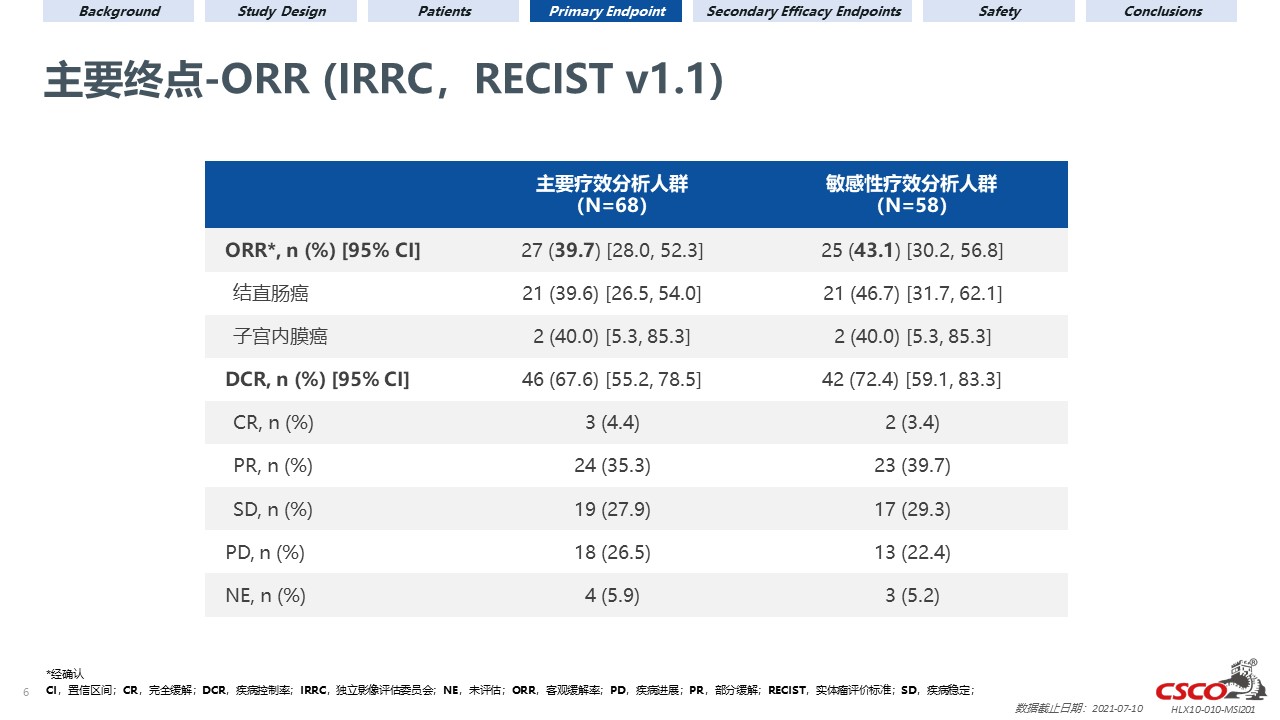
主要疗效分析人群及敏感性分析人群中,研究者评估的ORR分别为38.2%(95% CI 26.7–50.8;1例完全缓解)和41.4%(95% CI 28.6–55.1;1例完全缓解)。中位DOR、PFS及OS尚未达到。主要疗效分析人群及敏感性分析人群的12个月生存率分别为74.5%(95% CI 62.2–83.3)和82.4%(95% CI 69.7–90.1)。
在安全性分析集中,57(52.8%)名患者经历了三级及以上的治疗期间出现的不良事件(TEAEs),其中最常见的为贫血(9.3%)。13(12.0%)名患者经历了三级及以上的免疫相关不良事件(irAEs)。3(2.8%)名患者发生了可能与斯鲁利单抗相关的死亡(2例疾病进展,1例肠梗阻)。
结论
随着随访时间的增加,斯鲁利单抗仍展现出良好的抗肿瘤活性和安全性,为其作为一种有效的泛癌种抗癌药物提供了有力的支持。
