2025年6月10日,复宏汉霖(2696.HK)宣布,公司基于与宜联生物的合作开发的靶向程序性死亡-配体1(PD-L1)的新型抗体偶联药物(ADC)注射用HLX43在晚期非小细胞肺癌(NSCLC)患者中开展的国际多中心II期临床研究(HLX43-NSCLC201)于中国完成首例受试者给药。在刚刚召开的2025 美国临床肿瘤学会(ASCO)年会上,HLX43的I期临床数据首次发布,显示出令人鼓舞的初步疗效和安全性,对鳞状/非鳞状NSCLC,有无EGFR突变、有无脑/肝转移、PD-L1阳性/阴性的NSCLC患者都展现了优异的治疗潜力。目前,全球尚无同类靶向PD-L1的ADC产品获批上市,HLX43为全球首个进入临床II期的PD-L1 ADC。

广谱抗肿瘤ADC,剑指实体瘤全人群生存突破
近年来,以抗PD-(L)1抗体为代表的免疫检查点抑制剂(ICI)促进了肿瘤免疫治疗的高速发展,成为肿瘤患者各线治疗的主要手段之一。然而,部分患者对该疗法无响应,或者出现耐药[1]。对于免疫治疗耐药或经免疫治疗等标准治疗失败后的患者人群,尚缺少有效的后线治疗方案。ADC作为当下肿瘤治疗中疗效最突出的新型疗法,已在乳腺癌、肺癌、食管癌、胃癌等多项实体瘤中展现出令人振奋的治疗潜力,成为重要的探索方向[2]。而PD-L1作为一个泛肿瘤靶点,在非小细胞肺癌、头颈鳞癌、结直肠癌、三阴性乳腺癌、黑色素瘤等癌种中均有表达,部分瘤种阳性率(高表达+中低表达)超过50%,在肺癌上更高达70%,且在正常组织中表达有限,使其成为开发ADC药物的潜力靶点,为肿瘤治疗带来新的途径[3]。
据GLOBOCAN最新数据显示,肺癌是全球发病率和死亡率最高的癌症,2022年全球约有超过248万新发肺癌病例,占癌症新发病例的12.4%[4],其中非小细胞肺癌(NSCLC)是最常见的肺癌类型(约85%)。大部分肺癌患者确诊时已处于疾病晚期阶段[5],存在巨大的尚未满足的临床需求。根据病理类型,NSCLC又可分为鳞状细胞癌(约30%)、肺腺癌(约50%)等,尽管针对EGFR等驱动基因突变(AGA)的靶向治疗方案已经趋于成熟,但在全部NSCLC患者中,EGFR野生型占比高达70%-85%,涵盖几乎所有的鳞癌患者和50-55%的肺腺癌患者[6]。当前疗效优异的产品仍较少,特别在2L+人等后线人群治疗上,仍主要依赖于多西他赛为基础的化疗方案,后线治疗的效果有限[7,8]。
NSCLC疗效显著,全球首款进入II期临床的PD-L1 ADC
HLX43是一款靶向程序性死亡-配体1(PD-L1)的新型ADC候选药物,由全人源IgG1抗PD-L1抗体与创新连接子-拓扑异构酶抑制剂荷载偶联而成,药物抗体比(drug-to-antibody ratio, DAR)约为8。HLX43兼具毒素精准杀伤和肿瘤免疫作用的复合功能:其毒素不仅能够藉靶点内吞进入肿瘤细胞后进行释放,并在肿瘤微环境中释放后借助旁观者效应进入肿瘤细胞,阻断DNA复制,从而导致肿瘤细胞凋亡;此外,HLX43的PD-L1靶向抗体可激活免疫调节机制,发挥协同抗肿瘤效应。临床前及I期临床研究显示,HLX43具有显著的抗肿瘤疗效,且安全性良好。2.0 mg/kg每三周输注一次HLX43时,晚期NSCLC患者经研究者评估的ORR为38.1%,对于四线及更后线治疗的难治NSCLC患者,ORR仍可达38.5%。 其中鳞状非小细胞肺癌sqNSCLC(n=15)和非鳞状非小细胞肺癌nsqNSCLC(n=6)患者的客观缓解率(ORR)分别为40%和33.3%,并实现了73.3%和100%的疾病控制。值得关注的是,脑转移NSCLC患者全部得到疾病控制(DCR=100%)。相关临床前及I期临床研究数据分别于2023欧洲肿瘤内科学会(ESMO)大会和2025 美国临床肿瘤学会 (ASCO)年会上发布。
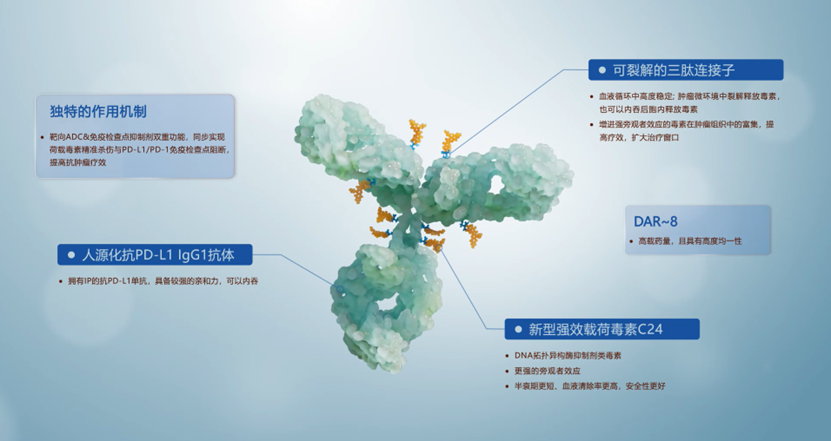
作为全球率先进入临床阶段的靶向PD-L1的ADC产品,HLX43于2023年相继获得中国药品监督管理局(NMPA)、美国食品药品监督管理局(FDA)的临床试验许可,目前已进入II期临床开发阶段,广泛覆盖非小细胞肺癌、胸腺鳞癌、肝细胞癌、食管鳞癌、头颈鳞癌、宫颈癌、鼻咽癌等实体瘤的治疗。单药之外,HLX43联用复宏汉霖自研斯鲁利单抗(H药汉斯状®,抗PD-1单抗)治疗实体瘤的 Ib/II 期临床试验也正在进行中,进一步探索“ADC+IO”的协同抗肿瘤疗效。HLX43不仅可能克服PD-1/L1免疫疗法不响应或耐药问题,并对化疗、TKI治疗失败的患者都具有潜在疗效,有望为更多晚期/转移性实体瘤患者带来新的治疗选择。
未来,复宏汉霖将持续立足于未满足的临床需求,充分发挥公司在抗体药物和抗体偶联药物领域的一体化平台优势,加速推动更多前沿治疗方案的研究和开发,为全球患者带来更多高质量、可负担的创新治疗方案。
HLX43-NSCLC201
本研究为一项评估HLX43在晚期非小细胞肺癌(NSCLC)患者的开放、国际多中心II期临床试验,旨在评估HLX43在晚期NSCLC患者中的有效性和安全性。研究分为两个阶段:第一阶段将进行剂量探索,以选择合适的HLX43剂量进行第二阶段研究。第二阶段为单臂、多中心II期临床研究。本研究的主要研究目的为评估HLX43在晚期非小细胞肺癌(NSCLC)中的临床疗效,次要研究目的为安全性、耐受性、药代动力学特征、免疫原性,以及探索潜在预测性或耐药性生物标志物。主要研究终点为由盲态独立中心审查委员会根据RECIST v1.1标准评估的客观缓解率。
