2025年11月2日,复宏汉霖(2696.HK)于2025肺癌前沿及创新国际论坛上公布公司自主研发的重组抗EGFR单克隆抗体HLX07联合抗PD-1单抗H药 汉斯状®(斯鲁利单抗)用于一线治疗EGFR高表达晚期或转移性鳞状非小细胞肺癌(sqNSCLC) II 期剂量探索研究的最新随访数据。2025年9月,该研究于世界肺癌大会(World Conference on Lung Cancer)公布中位随访18.6个月的数据,此次更新数据显示,在中位随访23.5个月时,该联合方案持续展现出与此前一致的疗效与安全性结果,进一步验证了该联合方案在EGFR高表达sqNSCLC人群中的临床获益潜力。

EGFR高表达人群:庞大但被忽视的临床空白
在全球非小细胞肺癌(NSCLC)患者中,EGFR高表达的比例约为40%–89%(取决于病理分型、种族等因素),意味着每年有数百万新发患者属于这一人群1-3。在sqNSCLC患者中,这一比例更高,接近90%1,2。值得注意的是,EGFR高表达与EGFR敏感突变并不等同,二者之间的相关性较低4。经典敏感性EGFR突变在sqNSCLC总体较为罕见5。这意味着,多数 EGFR高表达的鳞癌患者并不携带敏感性EGFR突变,因此无法从EGFR-TKI(酪氨酸激酶抑制剂)类靶向药中获益5。
目前,晚期或转移性sqNSCLC的一线标准治疗以PD-(L)1抑制剂联合化疗为主,但这些研究未针对EGFR表达水平进行患者筛选。这意味着EGFR高表达患者的治疗反应尚未得到充分研究和验证。这一人群仍缺乏基于生物标志物的精准治疗方案,临床实践多沿用“非分层”的通用方案,其治疗反应或存在显著差异的空间。
机制优势:双靶点协同,优势互补
西妥昔单抗是首批进入临床并在结直肠癌及头颈部鳞癌中获得批准的EGFR靶向单克隆抗体,然而其在肺癌的一线治疗中尚未获得适应症批准6-9。相比之下,复宏汉霖自主开发的HLX07具备更低的免疫原性和更好的靶点亲和力;同时通过Fc端改造,显著延长半衰期,实现三周一次给药,与免疫治疗给药节奏高度契合,不仅提升了联合治疗的便利性,也有助于保持持续的协同抗肿瘤效应。临床前研究表明,HLX07具有更出色的生物活性,在不同肿瘤模型中均能显著抑制肿瘤细胞的生长,并与H药显示出很强的协同作用10。H药作为全球首个一线获批用于广泛期小细胞肺癌的抗PD-1单抗,迄今已覆盖全球近半数人口。两者联用,不仅阻断EGFR生长信号,更同步激活免疫应答,极具联合协同治疗潜力。

临床信号积极,安全性可控
HLX10HLX07-sqNSCLC-201研究是一项随机、多中心的II期剂量探索研究,包括4个部分,评估了HLX07(不同剂量)、斯鲁利单抗和化疗的多种组合。第3部分评估了三药组合的初步有效性,EGFR高表达(H评分≥150)且无既往系统治疗的患者被1:1随机分至两组,分别接受静脉注射HLX07 800 mg或1000 mg,联合斯鲁利单抗和化疗。
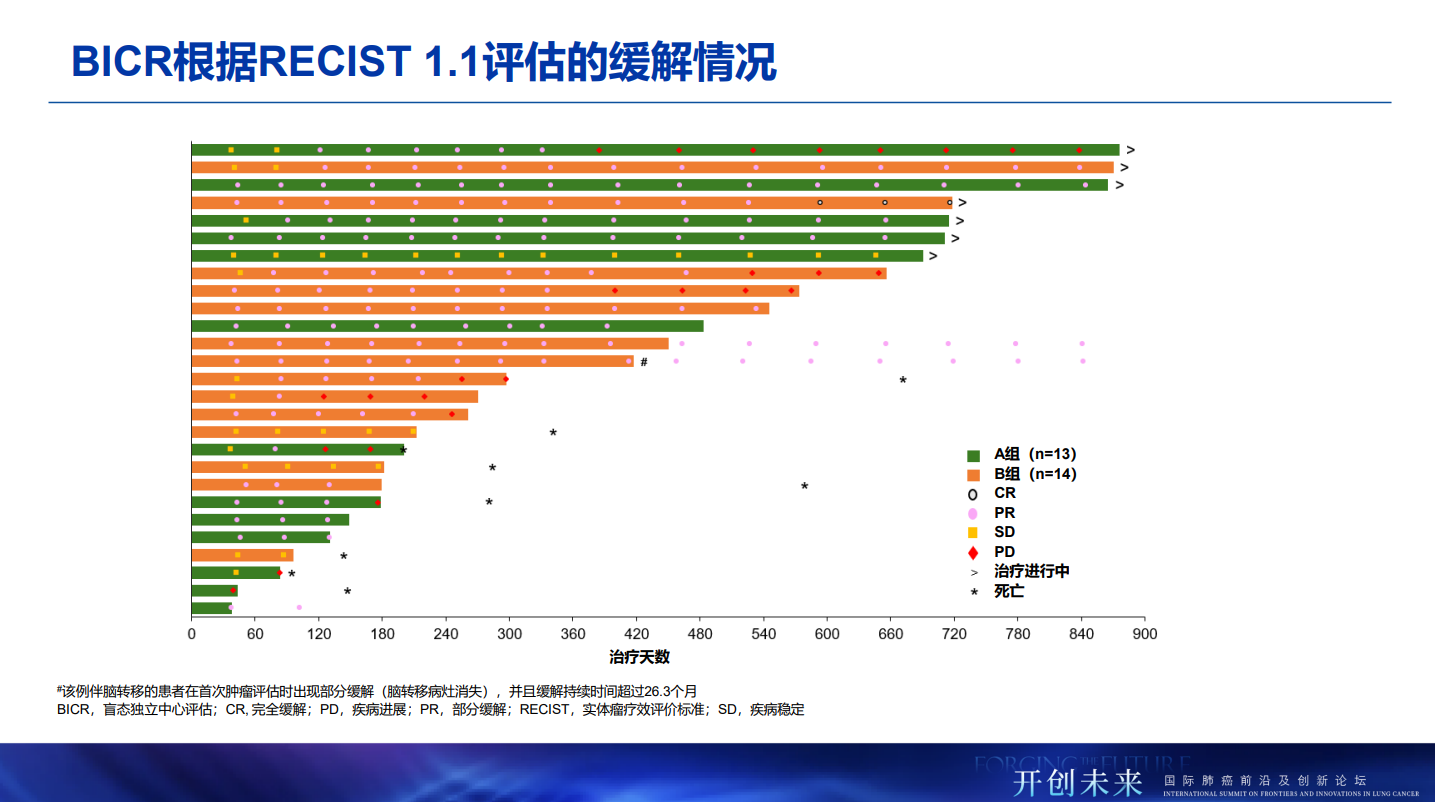
在最新的中位随访23.5个月分析中,两个剂量组均实现了约70%的客观缓解率(ORR)和超过90%的疾病控制率(DCR),与18.6个月随访时的数据保持一致。高剂量组的中位无进展生存期(PFS)为17.4个月,低剂量组的中位PFS在随访时仍未达到;两组的中位总生存期(mOS)和持续缓解时间(mDOR)均未达到。这意味着HLX07联合H药及化疗的治疗获益不仅早期显著,而且在更长的时间维度上得以维持,进一步增强了该方案在EGFR高表达sqNSCLC人群中的潜在临床价值。多数治疗期间的不良事件(TEAEs)如皮疹等均在可控范围内,与先前结果一致,未观察到新的安全性信号。
详细数据
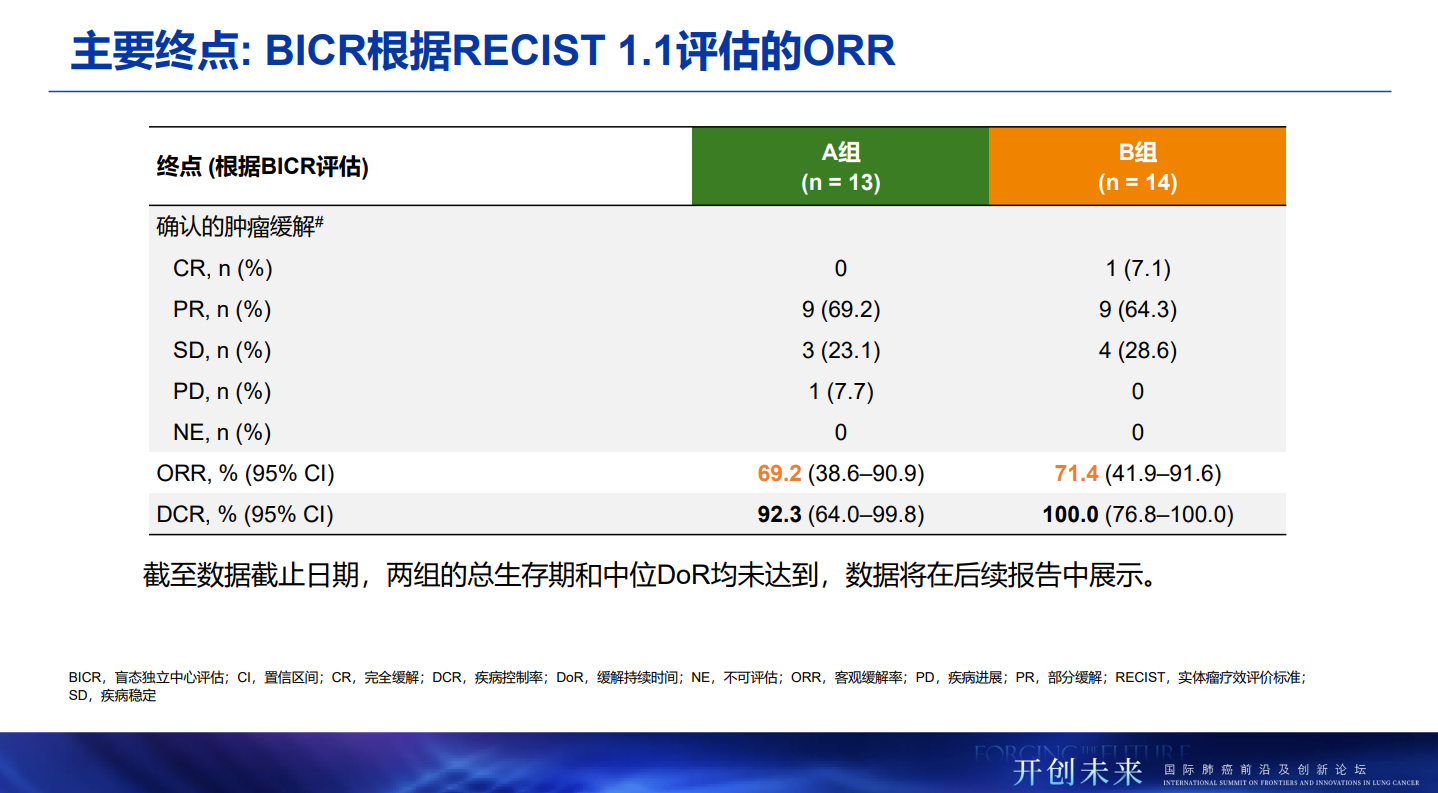
截至2025年7月31日,共有27例患者参与并随机分配至研究第3部分的A组(n=13)或B组(n=14)。两组患者分别每三周一次接受800 mg HLX07(A组)或1000 mg HLX07(B组)联合300 mg斯鲁利单抗和化疗。15例(55.6%)患者患有转移性sqNSCLC。中位随访时间为23.5个月。

A组和B组中,盲态独立中心审查委员会(BICR)根据RECIST 1.1评估的确认ORR分别为69.2%(95% 置信区间[CI] 38.6–90.9)和71.4%(95% CI 41.9–91.6),疾病控制率分别为92.3%(95% CI 64.0–99.8)和100%(95% CI 76.8–100.0)。A组的中位PFS尚未达到,B组中位PFS为17.4个月(95% CI 8.1–不可评估)。截至数据截止日期,两组的mOS和mDOR均未达到。两组所有患者均报告了治疗期间不良事件(TEAEs),常见的≥3级TEAEs以皮肤反应、电解质紊乱为主,与同类药物相比,未发现新的安全性信号。
复宏汉霖在肺癌治疗领域持续深耕,从H药引领小细胞肺癌免疫治疗,到HLX43、HLX07等多元管线布局非小细胞肺癌多个分子特征,公司正逐步构建差异化、全人群覆盖的免疫治疗产品矩阵。本研究的更长随访结果进一步验证了EGFR靶向与免疫治疗联合的可行路径,也为EGFR高表达sqNSCLC人群的精准治疗提供了新的思路和希望。
【参考文献】
[1] Prabhakar CN. Epidermal growth factor receptor in non-small cell lung cancer. Transl Lung Cancer Res. 2015;4(2):110-118. doi:10.3978/j.issn.2218-6751.2015.01.01
[2] Karlsen E-A, Kahler S, Tefay J, Joseph SR, Simpson F. Epidermal Growth Factor Receptor Expression and Resistance Patterns to Targeted Therapy in Non-Small Cell Lung Cancer: A Review. Cells. 2021; 10(5):1206. https://doi.org/10.3390/cells10051206
[3] The Cancer Genome Atlas Research Network. Comprehensive genomic characterization of squamous cell lung cancers. Nature 489, 519–525 (2012). https://doi.org/10.1038/nature11404
[4] Hadimaleki S, Sarmadian R, Gilani A, Mehrasa P, Esfahani A, Raeisi M, Roosta Y, Vahedi A. Analysis of EGFR Mutation and Its Association with PD-L1, ALK, and ROS1 Alterations in Patients with Non-Small-Cell Lung Cancer: The Most Extensive Study Conducted in Iran. Turk J Pathol. 2025;41(3):71-76. doi:10.5146/tjpath.2025.13827
[5] The Cancer Genome Atlas Research Network. Comprehensive genomic characterization of squamous cell lung cancers. Nature 489, 519–525 (2012). https://doi.org/10.1038/nature11404
[6] 国家药品监督管理局(NMPA). 爱必妥(西妥昔单抗)注射液 说明书(最新版本). NMPA说明书/信息公开平台. 检索日期:2025-10-28. https://www.nmpa.gov.cn/
[7] U.S. Food and Drug Administration. Erbitux (cetuximab) Prescribing Information. Accessed 2025-10-28. https://www.accessdata.fda.gov/
[8] European Medicines Agency (EMA). Erbitux 5 mg/mL concentrate for solution for infusion: Summary of Product Characteristics. Accessed 2025-10-28. https://www.ema.europa.eu/en/medicines/human/EPAR/erbitux
[9] Ciardiello F, Tortora G. EGFR antagonists in cancer treatment. New England Journal of Medicine. 2008;358(11):1160–1174. doi:10.1056/NEJMra0707704.
[10] Tseng,Yun-Chih Cheng, Chieh-Hsin Ho, Shih Chieh Chen, Yanling Wang, Eugene Liu,Hassan Issafras & Weidong Jiang (2021) Distinguishing features of a novelhumanized anti-EGFR monoclonal antibody based on cetuximab with superiorantitumor efficacy, Expert Opinion on Biological Therapy, 21:11, 1491-1507.
