2025年12月29日,复宏汉霖(2696.HK)宣布,公司自主研发的创新型重组人源化抗PD-L1与VEGF双特异性抗体HLX37在晚期/转移性实体瘤受试者中开展的首次人体临床试验(HLX37-FIH101)已于中国完成受试者给药。
HLX37作用机制结合了两种治疗路径:1)阻断PD-1 /PD-L1结合:通过阻断肿瘤细胞表面的PD-L1蛋白与免疫细胞(如T细胞)上的PD-1受体结合,解除肿瘤免疫抑制,恢复T 细胞对肿瘤的杀伤能力;2)阻断血管生成通路:靶向VEGF,减少肿瘤血管生成,从而限制肿瘤的血液供应生长和转移。研究表明,通过特异性结合肿瘤细胞PD-L1实现肿瘤内部具有抗VEGF功能的HLX37 双抗分子的富集,HLX37能够实现大于抗PD-L1 单抗和抗VEGF 单抗的联合疗效。临床前研究表明,该候选分子具有优异的抗肿瘤活性且安全性可控,同时能增强肿瘤富集效应,在多类肿瘤中具有广泛的应用潜力。该研究结果在2025年美国癌症研究协会(AACR)年会上首次发布[1]。
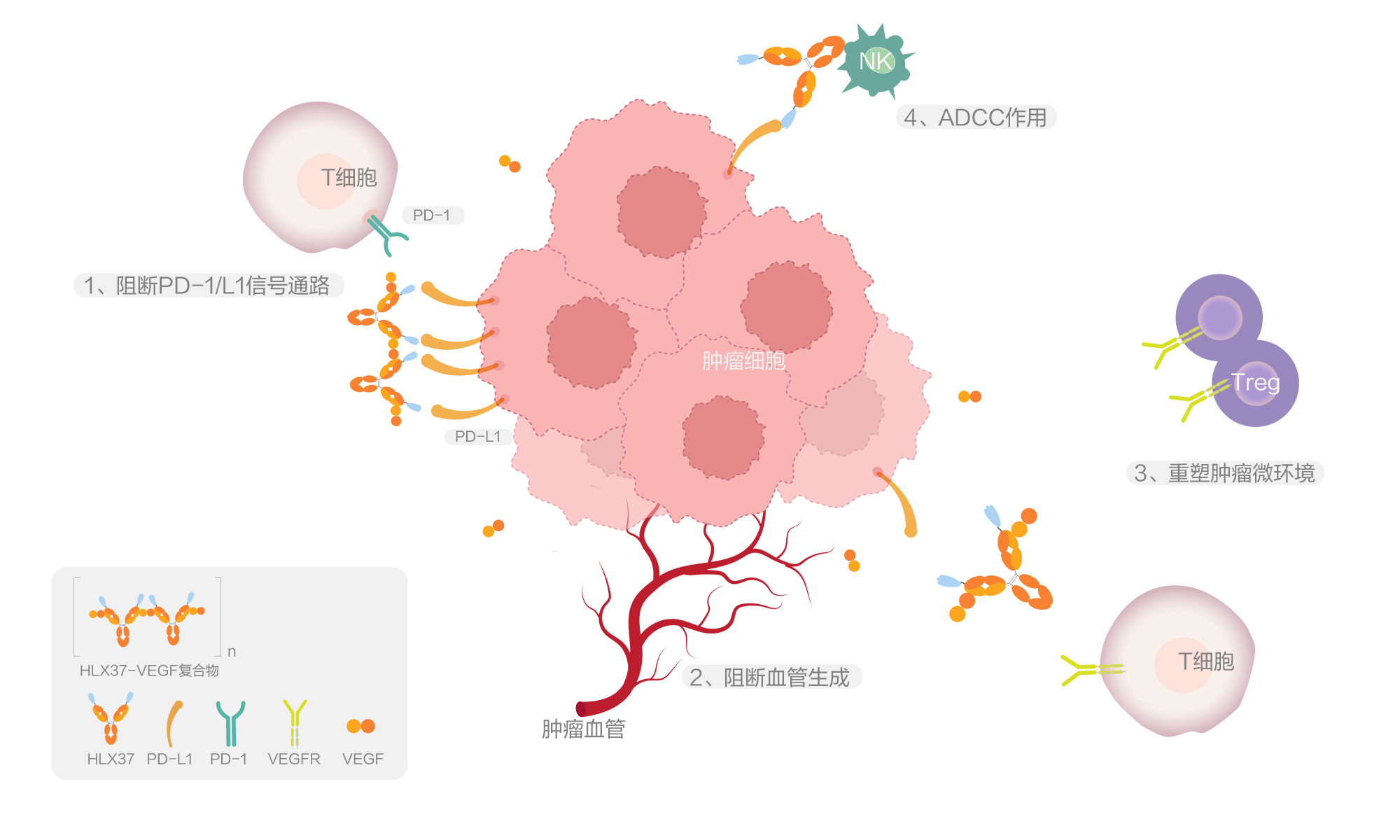
HLX37由抗VEGF 抗体与抗PD-L1的VHH片段融合而成, 该VHH序列筛选自复宏汉霖的合成VHH库。复宏汉霖已构建起“从源头发现到规模化生产”的一体化抗体技术平台,成为驱动差异化抗体药物研发的核心引擎。平台聚焦功能阻断性抗体开发,打造了强大的天然/合成人源化/免疫羊驼VHH多样化抗体库,可针对不同靶点灵活筛选出高亲和力、高特异性的纳米抗体(VHH)及scFv,为多特异性抗体等创新分子的开发奠定基础。同时,基于长期行业积淀,公司已系统性建立多特异性抗体(双抗/三抗/四抗)与抗体融合蛋白的发现、构型设计与功能表征数据库,显著提升了复杂抗体分子的开发效率与成功率。依托于该平台,公司已累计实现了10款产品的获批上市,并持续推进19款临床阶段资产(涵盖创新单抗/ADC/融合蛋白/生物类似药)的高效开发,在研临床项目超过30项,通过全链条的开发能力与获验证的规模化CMC体系,加速推动潜力候选分子转化为高质量的临床与商业化产品。
未来,复宏汉霖将继续秉持“以患者为中心”的初心和理念,深耕实体瘤这一重要疾病领域,通过不断挖掘患者未满足的临床需求,持续夯实更多创新分子的差异化布局,为更多肿瘤患者带来高质量、可负担的新型治疗方案。
【参考文献】
[1] Song G, Chen Y-S, et al. Abstract 7303: A novel anti-PD-L1/VEGF bispecific antibody (HLX37) with immune checkpoint inhibition, anti-angiogenic, and antineoplastic activities. Cancer Res 15 April 2025; 85 (8_Supplement_1): 7303. AACR Annual Meeting 2025.
关于HLX37-FIH101
HLX37-FIH101是一项评估HLX37在晚期/转移性实体瘤受试者中安全性、耐受性、药代动力学(PK)特征及初步疗效的开放性、首次人体I期临床试验,共分为Ia期剂量递增(含单药及联合治疗)和Ib期剂量扩展两个阶段。Ia期单药治疗针对晚期实体瘤受试者,设置1.0 mg/kg至45.0 mg/kg共6个剂量水平,每三周给药一次;联合治疗将在晚期非小细胞肺癌受试者中探索不同剂量HLX37联合培美曲塞或白蛋白紫杉醇/紫杉醇及卡铂的方案;Ib期的给药方案及拟扩展瘤种将根据Ia期研究结果决定。本研究的主要终点旨在评估剂量限制性毒性(DLT)发生率,以确定单药及联合治疗的最大耐受剂量(MTD)和II期推荐剂量(RP2D);次要终点包括不良事件等安全性指标、PK参数、免疫原性,以及客观缓解率(ORR)、无进展生存期(PFS)和总生存期(OS)等疗效指标,同时探索潜在预测性生物标志物。
