9月20日下午,在第21届全国临床肿瘤学会(CSCO)年会的国际白血病·淋巴瘤专场上,中国医学科学院肿瘤医院石远凯教授公布了复宏汉霖HLX01与原研利妥昔单抗相似性研究3期临床试验数据。

会上,石远凯教授报告了HLX01与原研利妥昔单抗治疗弥漫大B细胞淋巴瘤(DLBCL)的多中心、随机、双盲、头对头对照3期研究结果,该研究表明,HLX01组与原研利妥昔单抗组疗效等效性成立。

研究目的
在DLBCL患者中,以原研利妥昔单抗联合CHOP方案(环磷酰胺、多柔比星、长春新碱及强的松)作为阳性对照,比较HLX01联合CHOP作为一线治疗方案的临床疗效及安全性。
研究终点
主要研究终点为比较试验组和对照组对初治DLBCL患者6周期内的ORR,包括完全缓解(CR)及部分缓解(PR); 次要终点包括完全缓解率、1年反应持续时间 (DOR)、1年无事件生存(EFS)率、1年无进展生存(PFS)率、1年总生存(OS)率、1年无病生存(DFS)率及群体药效动力学(PD)参数。
研究结果
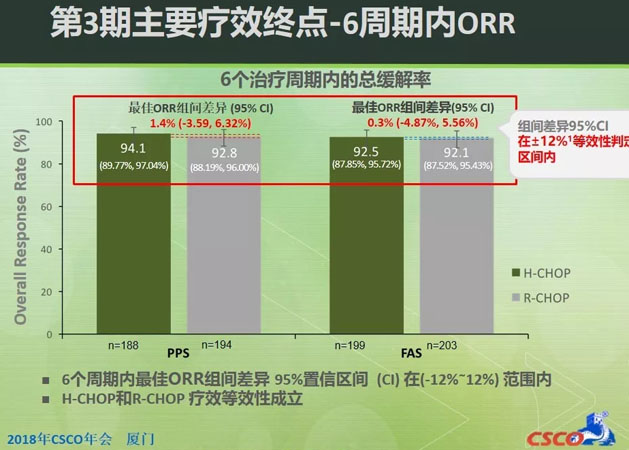
HLX01第3期临床试验证实了HLX01与原研利妥昔单抗的疗效和安全性相似。HLX01与原研利妥昔单抗联合CHOP的6个周期内最佳总缓解率为92.5%比92.1%(全分析集)。组间差异95%置信区间(CI)在预设的等效区间内(-12%~12%),疗效等效性确立。
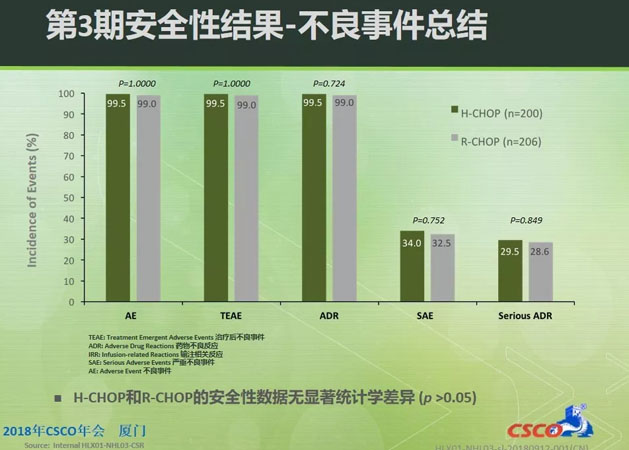
在安全性方面,HLX01和原研利妥昔单抗的不良事件(AE)、治疗后不良事件(TEAE)和严重不良事件(SAE)数据均相似,无统计学差异。免疫原性的研究结果显示两组的抗药抗体(ADA)阳性率也相近。以上3期临床试验结果表示,HLX01具有与原研利妥昔单抗相似的疗效和安全性。
关于HLX01
HLX01为复宏汉霖自主研发的首个单克隆抗体生物类似药,主要适用于非霍奇金淋巴瘤(NHL)、类风湿性关节炎(RA)的治疗。其原研药于1997年获得美国FDA批准,是第一个用于肿瘤治疗的单克隆抗体药物。值得关注的是,2017年9月,HLX01已收到上海食药监局颁发的《药品生产许可证》。2017年10月,复宏汉霖就HLX01向CFDA递交新药上市申请(NDA)并获受理,这也是中国自主研发的第一个真正意义上以生物类似药路径申报上市的单抗生物药。
关于复宏汉霖
上海复宏汉霖生物技术股份有限公司由复星医药与海外科学家团队于2009年12月合资组建,公司主要致力于应用前沿技术进行生物类似药、生物改良药以及创新型单抗的研发及产业化,在中国上海、台北和美国加州均设有研发中心,产品覆盖肿瘤、自身免疫性疾病等领域。
截至目前,复宏汉霖12个产品、1个联合治疗方案已完成20项适应症的临床试验申请,累计获得全球范围内25个临床试验许可(中国大陆15个,中国台湾3个,美国3个,欧盟、澳大利亚、乌克兰和菲律宾各1个)。
