近日,復宏漢霖自主研製的HLX22單抗注射液(以下簡稱“該新藥”)獲國家藥品監督管理局臨床試驗註冊審評受理,未來可用於胃癌和乳腺癌的治療。

HLX22是復宏漢霖從AbClon, Inc.(以下簡稱“AbClon”)受讓、並後續自主研發的創新型治療用生物製品,是一款針對HER2靶點開發的人源化lgG1單克隆抗體注射液。自2016年來,復宏漢霖陸續與AbClon簽訂《授權合約》和《修正協議》,AbClon獨家許可復宏漢霖在全球範圍內對該新藥的開發與商業化權利。
未來,憑藉良好的臨床前表現,HLX22將不僅作為單藥產品在乳腺癌和胃癌的治療中發揮重要作用,更有機會協同同靶點產品HLX02(復宏漢霖自主研發的曲妥珠單抗生物類似藥),躋身HER2陽性胃癌國際First-in-class的聯合治療方案,進一步推動復宏漢霖全球化戰略的落地,以質高價優的生物藥,造福全球更多病患。
關於復宏漢霖
上海復宏漢霖生物技術股份有限公司由復星醫藥與海外科學家團隊於2009年12月合資組建,公司主要致力於應用前沿技術進行生物類似藥、生物改良藥以及創新型單抗的研發及產業化,在中國上海、台北和美國加州均設有研發中心,產品覆蓋腫瘤、自身免疫性疾病等領域。
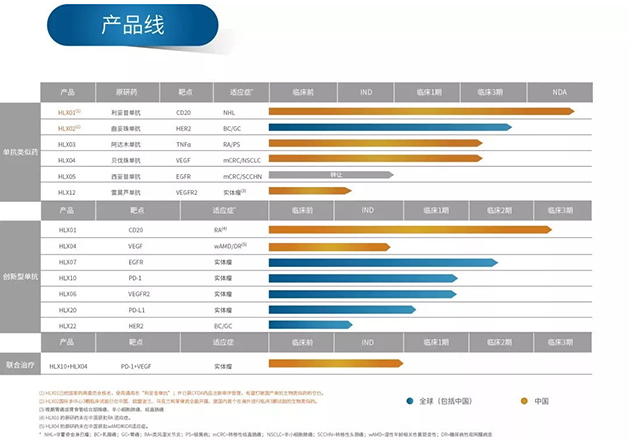
截至目前,復宏漢霖13個產品、1個聯合治療方案已完成22項適應症的臨床試驗申請,累計獲得全球範圍內27個臨床試驗許可(中國大陸17個,中國台灣3個,美國3個,歐盟、澳大利亞、烏克蘭和菲律賓各1個)。公司首個治療淋巴瘤的產品利妥昔單抗注射液(美羅華®生物類似藥)目前已獲國家食品藥品監督管理總局(現為國家藥品監督管理局)藥品註冊審評受理,有望打破國產生物類似藥市場的空白。
