在2019年11月22日至11月24日於新加坡舉行的2019年歐洲腫瘤學會亞洲分會ESMO-Asia年會上,復宏漢霖分享了HLX02(注射用曲妥珠單抗)的最新研究進展。

以下為本次數據發佈的詳細信息:
HLX02
論文題目:First China-Manufactured Trastuzumab Biosimilar HLX02 Global Phase 3 Trial Met Primary Endpoint in Breast Cancer
發佈形式:Late-Breaking口頭報告,編號LBA6
時間:2019年11月23日 09:12-09:24
地點:新加坡新達城國際會議展覽中心 405會議室 乳腺癌專場
HLX02是復宏漢霖自主研發的注射用曲妥珠單抗,它的開發遵從國家葯監局(NMPA)和歐洲藥品管理局(EMA)生物類似葯指導原則,旨在增加全球患者對曲妥珠單抗治療的可及性。復宏漢霖先後於2018年CSCO大會和ESMO-Asia大會上發佈了其1期臨床試驗(NCT02581748)的結果,驗證了HLX02與不同來源的原研曲妥珠單抗(中國市售和歐洲市售)達到葯代動力學生物等效,安全性相似。在今年CSCO大會上,復宏漢霖發佈了HLX02 3期臨床試驗的部分亞組分析結果,並在ESMO大會上進一步報告了該試驗不同分析集人群中的數據。HLX02 3期臨床試驗(HLX02-BC01, 臨床試驗號:NCT03084237;歐洲臨床試驗號:2016-000206-10)是一項在複發或未經治療的HER2過度表達轉移性乳腺癌患者中開展的隨機、雙盲、平行對照試驗,旨在比較HLX02與原研曲妥珠單抗(歐洲市售)在乳腺癌患者中的有效性和安全性。現在,我們在ESMO-Asia 2019大會上報告了該試驗在所有研究人群中用藥24周的有效性結果及最新安全性數據。
此次HLX02 3期試驗成功入選了ESMO-Asia大會Late-Breaking口頭報告, 在23日上午新加坡新達城國際會議展覽中心-405會議室進行口頭報告。據悉,本次大會組委從眾多乳腺癌領域入選的摘要中遴選出了5個重點研究,在乳腺癌領域的專題討論(Proffered papersession-Breast cancer)中進行口頭報告,並組織專家進行提問和討論,該試驗便是其一。本場討論會由來自新加坡國家癌症中心的R.Dent教授主持。在討論會現場,許多專家表示HLX02 3期臨床研究的陽性結果令人喜悅,並對HLX02在提高患者可及性方面的市場潛力抱以期待。
試驗設計
這項3期臨床試驗入組了來自4個國家(中國,烏克蘭,菲律賓,波蘭)89個研究中心既往未經治療的複發性或轉移性HER2陽性乳腺癌患者。入組患者需滿足的主要條件為:≥18歲的成年女性且患有複發性或轉移性乳腺癌、病理檢測HER2陽性(FISH≥2.0或IHC得分3+)、未進行過全身性化療或靶向藥物治療、體力狀況較好(ECOG評分0~1)。患者按照1:1的比例隨機分為兩組,分別給予HLX02聯合多西他賽治療或原研曲妥珠單抗(歐洲市售)聯合多西他賽治療。兩組患者均採用每3周一次,最多12個月的給藥方案。主要療效終點為24周(8個治療周期)的最佳總緩解率(ORR24周)。
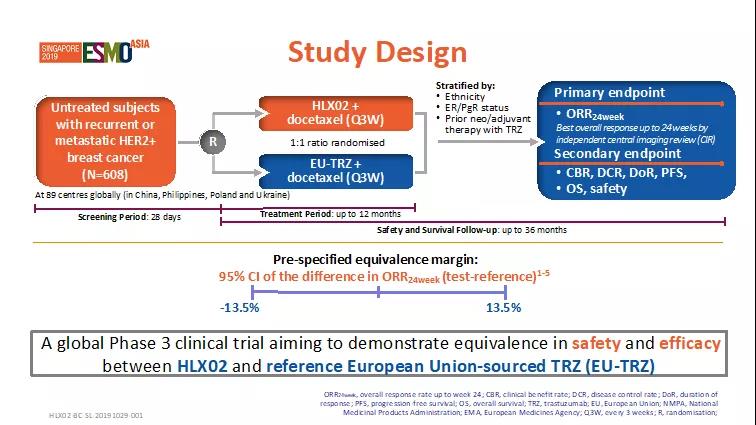
圖1. 試驗設計
試驗結果
數據截止日期 2018年11月27日
有效性-主要終點
截止2018年11月27日,共649例患者被隨機分配到兩個治療組(HLX02組=324;原研組=325)。HLX02組24周的最佳總緩解率為71.0%,原研組為71.4%,兩組間無統計學差異。ORR24周組間差異為-0.4%,其95%置信區間 (-7.4%, 6.6%) 在預設等效區間內(-13.5%,+13.5%),HLX02和原研曲妥珠單抗(歐洲市售)療效等效性成立。除此之外,亞組(亞洲 vs. 非亞洲,中國vs.非中國)分析顯示,HLX02組與原研組ORR24周在不同人群中無統計學差異(p>0.05),進一步驗證了HLX02與原研曲妥珠單抗(歐洲市售)的療效相似性。
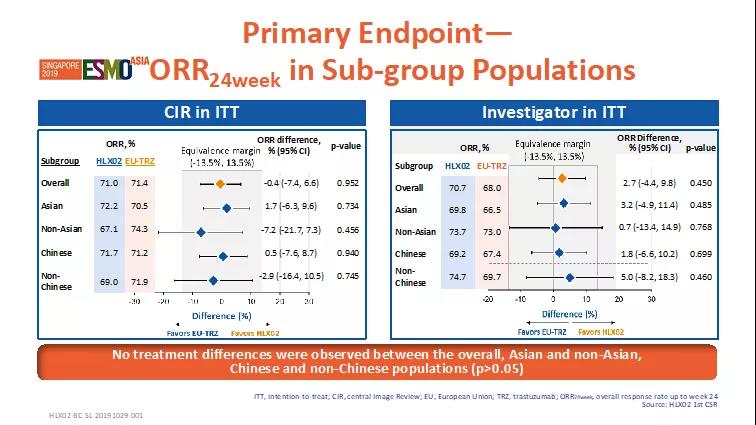
圖2. 主要終點ORR24周-亞組分析
有效性-次要終點
次要療效終點如臨床獲益率(CBR)、疾病控制率(DCR)、緩解持續時間(DoR)、無進展生存期(PFS)、總生存率(OS)等,兩治療組間無統計學差異(p>0.05)。
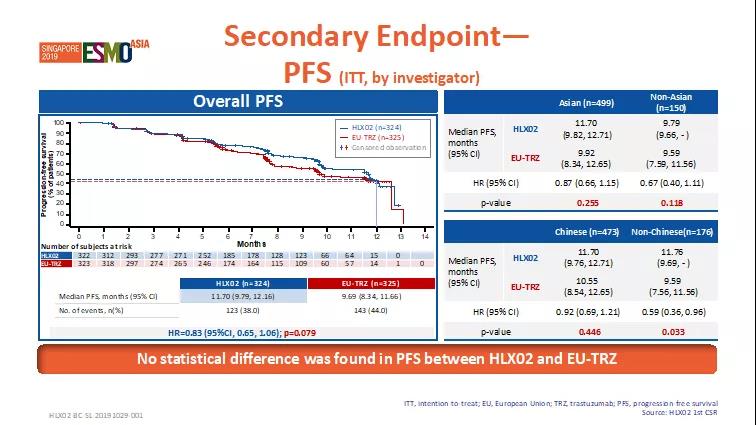
圖3. 次要終點-無進展生存期PFS
安全性結果
HLX02和原研曲妥珠單抗(歐盟市售)安全性(包括心臟疾病相關的不良事件發生率, 圖4)相似(p>0.05)。
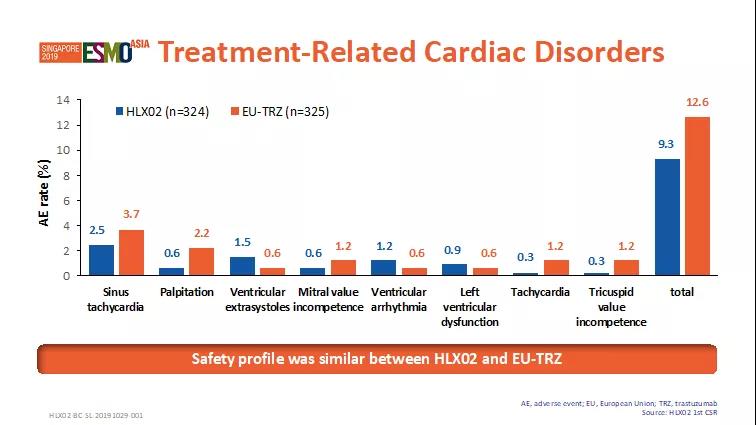
圖4. 安全性-藥物相關的心臟疾病
結論
HLX02和原研曲妥珠單抗(歐洲市售)24周的最佳總緩解率組間差異95%置信區間在預設的等效區間內,兩治療組療效等效性成立。截止到數據截止日,所有HLX02的次要療效和安全性分析結果均支持HLX02與原研曲妥珠單抗(歐洲市售)在既往未經治療的複發性或轉移性HER2陽性乳腺癌患者中生物相似性成
