在2019年11月22日至11月24日於新加坡舉行的2019年歐洲腫瘤學會亞洲分會ESMO-Asia年會上,復宏漢霖分享了HLX10(重組抗PD-1人源化單克隆抗體注射液)治療晚期實體瘤療效及安全性的1期臨床試驗( NCT02648490)最新研究進展。
以下為本次數據發佈的詳細信息:
HLX10
論文題目:A Novel Anti-PD-1 Antibody HLX10 Study Led to the Initiation of Combination Immunotherapy
講者:趙祖怡 衛生福利部雙和醫院
壁報編號:324P
時間:2019年11月23日18:00-18:30
地點:新加坡新達城國際會議展覽中心展覽大廳level4
近年來,程序性細胞死亡蛋白-1(PD-1)及其配體(PD-L1)因獨特的作用機制和相對低的副作用等特點,引起了全球醫療研究人員的極大關注,並在眾多腫瘤治療領域取得了令人矚目的成果。HLX10作為復宏漢霖自主研發的創新型單抗,體外試驗被證實能夠增強T細胞的功能,並在腫瘤移植模型中表現出抗腫瘤活性。今天,我們公布了HLX10在複發或轉移性晚期實體瘤中1期臨床試驗的最新試驗數據,該試驗旨在探索HLX10在晚期或轉移性實體瘤患者中的安全性、耐受性、劑量限制性毒性(DLT)、最大耐受劑量(MTD)、葯代動力學(PK)和初步療效。
試驗設計
HLX10的1期臨床試驗為一項在標準治療耐葯的晚期或轉移性實體瘤患者中開展的多中心、開放式的劑量遞增試驗。該研究採用貝葉斯最優區間(BOIN)設計,旨在探索HLX10的最大耐受劑量(MTD)。入組後,患者每兩周靜脈輸注0.3,1,3,10mg/kg 的HLX10直至疾病進展, 退出試驗, 死亡或治療滿12個月。首次給葯28天內,觀測劑量限制性毒性(DLT)。 臨床療效使用1.1版實體瘤的療效評價標準(RECIST)和免疫RECIST(iRECIST)進行評估,前24周每8周評價一次,之後每12周評價一次。在試驗期間,我們同步評估了HLX10的葯代動力學、藥效學特性和安全性。
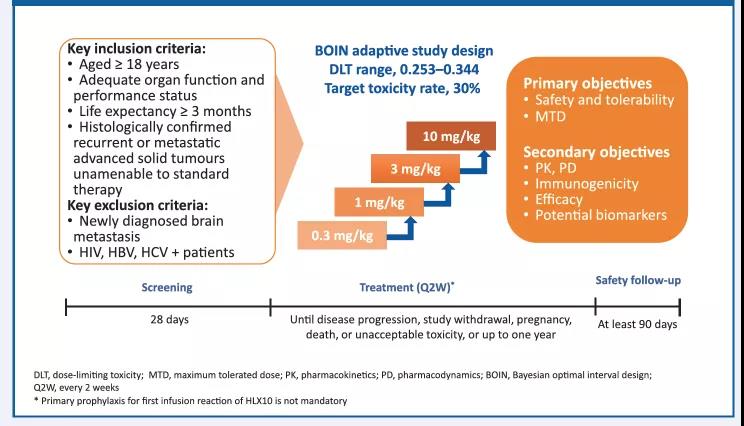
圖1. 試驗設計
試驗結果
該試驗在中國台灣開展。截止2019月10月28日,共入組患者19例,其中男性患者佔57.9%,中位年齡為60歲。
有效性結果
在19例接受療效評估的患者中,8例患者觀測到疾病穩定(SD),在3mg/kg劑量組中1例達到部分緩解(PR)(圖2)。
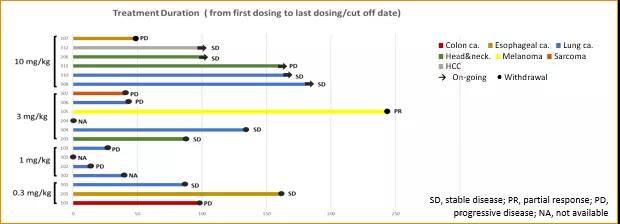
圖2. HLX10有效性結果
葯動學結果
HLX10葯動學參數與計量呈正相關性。
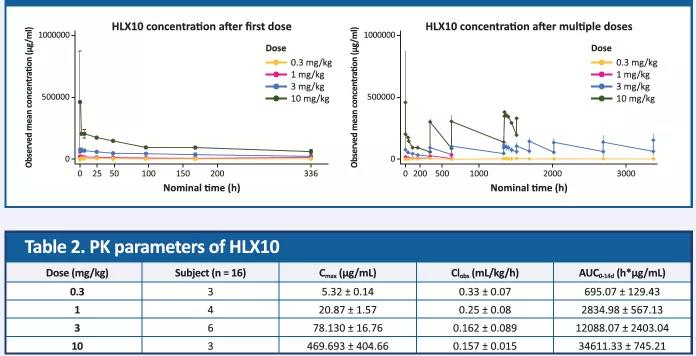
圖3. HLX10 平均血葯濃度(SD)-時間曲線
安全性結果
HLX10安全耐受性良好,大部分不良事件為1-2級。在3mg/kg劑量組,有1例患者達到劑量限制性毒性(DLT)。有7例患者發生大於3級的不良事件,其中,非心源性的胸痛最為常見(2【10.5%】)。
結論
• HLX10在複發或轉移性實體瘤患者中的耐受性良好,單葯治療在多種實體瘤患者中表現出令人期待的抗腫瘤活性。
• 此外,HLX10的臨床效果及安全性結果為正在進行的HLX10HLX04-001聯合治療試驗提供了有力依據,進一步的試驗將評估HLX10聯合HLX04(貝伐珠單抗生物類似葯)治療標準療法耐受的實體瘤患者。
