在2019年11月22日至11月24日於新加坡舉行的2019年歐洲腫瘤學會亞洲分會ESMO-Asia年會上,復宏漢霖分享了(抗EGFR單抗)治療晚期實體瘤療效及安全性的1期臨床試驗( NCT02648490)最新研究進展,該研究結果被評選為本屆會議「最佳壁報」之一。
以下為本次數據發佈的詳細信息:
HLX07
論文題目:A Novel Anti-EGFR Antibody HLX07 for Potential Treatment of Squamous Cell Carcinoma of the Head and Neck
講者:侯明模 林口長庚紀念醫院
壁報編號:68P
時間:2019年11月23日18:00-18:30
地點:新加坡新達城國際會議展覽中心展覽大廳level4
HLX07是復宏漢霖自主研發的改良型重組抗表皮生長因子(EGFR)人源化單克隆抗體注射液。臨床前研究顯示,在經過包括人源化改造、親和力成熟及穩定細胞株建構等一系列改良後,與國內已獲批的抗EGFR單抗西妥昔單抗(Cetuximab)相比,HLX07在不同腫瘤模型及在相同藥物劑量下,顯示出等效甚至更佳的腫瘤抑制效果和更低的毒性。
試驗設計
我們開展了一項前瞻性、開放性式、劑量遞增的1期臨床試驗,旨在評價不同劑量的HLX07在經標準治療失敗後的晚期實體瘤患者中的安全性、耐受性、葯代動力學(PK)特性和有效性。該試驗採用傳統的3+3劑量遞增方案,每個劑量組至少入組3例患者。入組後,患者每周靜脈輸注HLX07(50,100,200,400,600和800mg)直至疾病進展(PD),撤銷知情同意或死亡(由事件發生順序決定)。首次給葯28天內,評估劑量限制性毒性 (DLT),每8周通過計算機斷層掃描(CT)或磁共振成像(MRI)評估一次臨床療效。
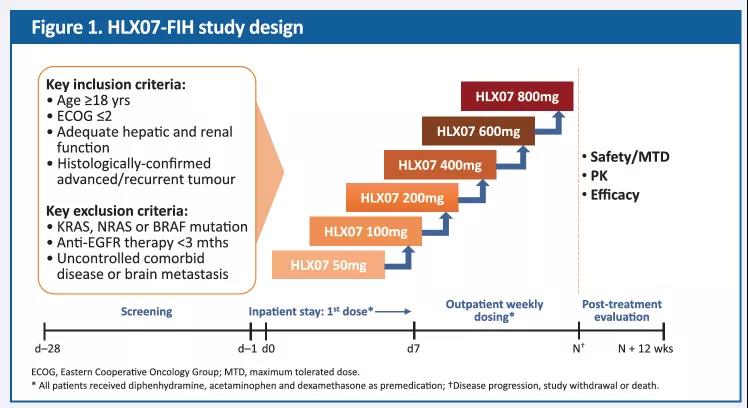
圖1. 試驗設計
試驗結果
該試驗在中國台灣開展。截至2019年6月13日,共入組患者19例,其中男性患者佔84.2%,中位年齡為58歲。
有效性結果
在17例可評估的患者中,在600mg劑量組觀測到1例部分緩解(PR),在所有劑量組有5例疾病穩定(SD)。
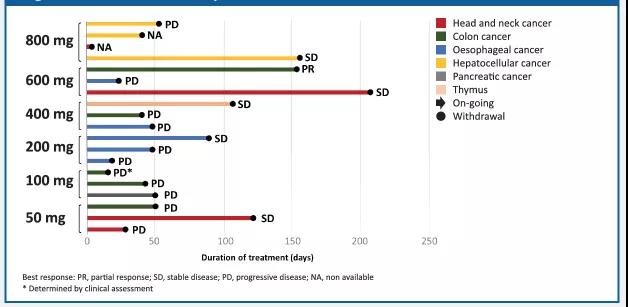
圖2. HLX07有效性結果
葯動學結果
隨着HLX07劑量的增加,葯動學參數與計量呈正相關性。
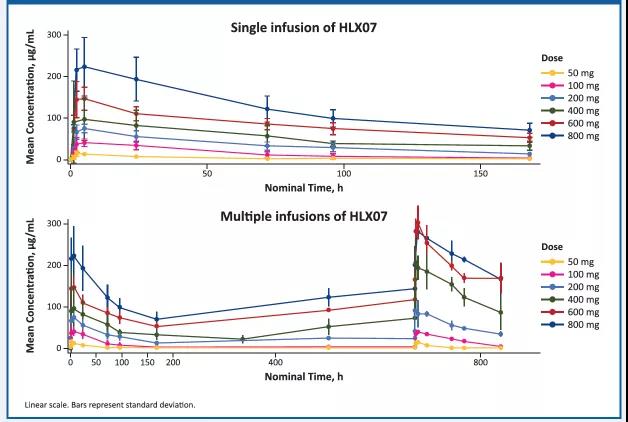
圖3. HLX07 平均血葯濃度(SD)-時間曲線
安全性結果
HLX07顯示出良好的安全耐受性。直至最高劑量組(800mg劑量組),試驗中均未出現劑量限制性毒性(DLT),也未達到最大耐受劑量(MTD)。6個劑量組中均未發現明顯的、超出預期的不良事件。
結論
•HLX07顯示出良好的安全耐受性:直至最高劑量組(800mg劑量組),試驗中均未出現劑量限制性毒性(DLT),也未達到最大耐受劑量(MTD)。
•HLX07顯示良好的腫瘤抑制效:17例可評價的患者中有1例部分緩解(PR),5例疾病穩定(SD)。
•此結果支持了HLX07開展其1b/2期臨床試驗(NCT03577704),進一步驗證HLX07聯合不同化療方案在晚期實體瘤患者中的安全性和有效性。
