復宏漢霖成為國內首個自主開發和生產抗體生物葯獲歐盟GMP認證的企業,打破了國產單抗生物葯海外上市的GMP壁壘。這是國產生物類似葯又一大突破,對於復宏漢霖踐行生物葯國際化戰略具有重要意義。
2020年4月23日,復宏漢霖宣布,公司已經順利通過HLX02曲妥珠單抗原液(DS)和製劑(DP)線的歐盟GMP現場核查,正式獲得波蘭衛生監督機構Chief Pharmaceutical Inspector簽發的兩項歐盟GMP證書(Certificate of GMP Compliance of a Manufacturer)。
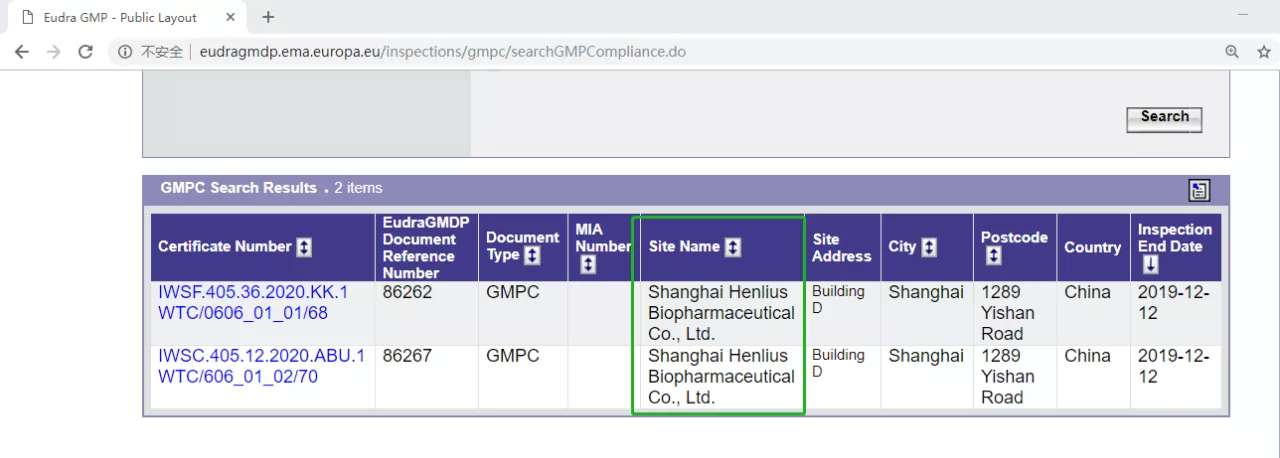
來源:EudraGMDP
HLX02曲妥珠單抗也由此成為國內首個獲得歐盟GMP認證的國產生物類似葯。歐盟GMP認證是國際公認的最權威和嚴謹的認證之一,不僅在近30個成員國之間彼此互認共享,同時也可與美國、加拿大等簽訂互認協議(MRA)的國家共享核查結果,在全球範圍內具有重大影響力,被視為藥品登陸國際市場的「通行證」。
10個月前,復宏漢霖自主研發的注射用曲妥珠單抗HLX02向EMA遞交上市申請並獲得受理,這是首個在中國開發和生產並在中國和歐盟雙雙進行申報上市的生物類似葯。根據EMA的監管規則,藥品上市申請獲受理後最多210天內,審評方需要給出上市審評意見。而現場核查是產品上市審評流程中的重要一環,一旦通過核查、獲得GMP認證,也意味着HLX02在歐盟獲批上市走完了180/210天。
毫無疑問,HLX02曲妥珠單抗將代表中國生物類似葯去歐盟這樣的主流市場與跨國葯企同台競技,代表了中國生物類似葯又一重大突破。而這不僅意味着HLX02拿到藥品國際市場「通行證」,也意味着復宏漢霖成功打破了國產單抗生物葯海外上市的GMP壁壘,具備了符合歐盟標準的商業化生產基地和質量管理體系,同時為此後更多的生物類似葯和生物創新葯陸續進入國際舞台、獲得更為廣闊的市場空間奠定了基礎。
01 藥品登陸國際市場的「通行證」
歐洲藥品管理局(EMA)成立於1995年、現總部位於荷蘭首都阿姆斯特丹,是全球生物類似葯先行者。歐盟生物類似葯產業發展領先於美國近十年,早在2004年,EMA就率先發佈了《生物類似葯指南(草案)》,並於2006年批准了全球首個生物類似葯Omnitrope(重組人生長激素),開創了全球生物類似葯新時代。而美國直到2010年才通過了《生物製品價格競爭和創新法案》(BPCI),明確生物類似物法規監管途徑,直到2015年4月28日,FDA才發佈了生物類似物指南終稿。
發展最早的歐盟也是目前全球上市生物類似葯最多的市場。2018年,全球生物類似葯規模達到了59.5億美元,其中領頭羊歐洲市場規模超過30億美元。根據醫藥魔方的數據顯示,截止2019年9月底,EMA累計批准生物類似葯數量已達62個,涵蓋了胰島素、人生長激素、單克隆抗體、非格司亭等9大生物產品種類,涉及16種具體的生物產品。
作為全球最早立法的監管機構,歐盟不僅積累了生物葯審批的成熟經驗,在不斷完善自身法律法規體系的同時,也在致力於為其他監管機構和WHO分享經驗。而一款生物類似葯獲得歐盟GMP認證,意味着其生產質量體系獲得了全球最嚴謹和權威標準的認可,進一步證明了藥品擁有了國際品質。
對標全球最高標準是復宏漢霖自創業以來就立下的目標。2010年,復宏漢霖創立,此時美國和中國都沒有生物類似葯相關技術標準。「我們就按照歐盟標準研發生物類似葯,包括於2016年完工的徐匯生產基地,其設計和施工也按照歐盟、中國和美國標準執行。」復宏漢霖聯合創始人、總裁兼首席執行官劉世高曾在接受E葯經理人專訪時表示。
事實上,生物類似葯的技術門檻極高,全球能夠進入歐美規範市場參與競技的葯企只有6~10家,包括諾華山德士、輝瑞、邁蘭、安進以及韓國的三星生物和Celltrion等,這從側面反映了闖關歐盟的巨大紅利與機會,以及未知的風險與挑戰。
而生物類似葯之所以門檻極高,除研發上的挑戰外,最核心的因素在於要求極其嚴格的生產質量體系建設,這也是跨國葯企之所以壟斷全球生物葯市場的主要原因。建立起這樣的質量體系至少需要7~10年時間,而行業人士認為中國在這方面整體落後歐美國家5~10年。
中國自2015出台《生物類似葯研發與評價技術指導原則(試行)》後,已經成為全球生物類似葯競爭最為激烈的國家。科睿唯安數據庫顯示,中國處於臨床階段管線數為89個,佔全球所有在研管線的35.5%,領先美國(26.4%)、印度(14.5%)和韓國(22.9%)。但截至目前,中國大陸只有復宏漢霖申報生物類似葯歐盟上市並通過歐盟GMP認證。復宏漢霖當之無愧成為中國生物類似葯代表和領先者。
02 為國際化質量標準買單
4個月前,E葯經理人在復宏漢霖上海徐匯區總部對復宏漢霖做了一次深入專訪和報道,彼時,位於總部旁邊的徐匯生產基地正在迎接EMA檢查員的現場核查。「這是非常重大的事情,HLX02在歐盟申報上市的意義,不僅僅是搶佔市場,更重要的是向全世界證明,復宏漢霖能夠做什麼,以及將來要做什麼。」劉世高接受採訪時說。
復宏漢霖從創業開始,便將眼光標準國際化。而這一前瞻性的目標無疑將為復宏漢霖帶來豐厚的回報。從市場格局來看,我國醫藥市場正在面臨價格變局,大部分原研葯定價低於美國等市場,相應的仿製葯和生物類似葯的價格也面臨天花板。同時,生物類似葯在中國競爭逐漸加劇,復宏漢霖作為國內生物類似葯第一梯隊,堅持對標國際標準,使中國患者能夠獲得全球同生產線和質量體系的高品質藥品。有了歐盟GMP認證的加持,無疑將增加其產品在國內市場的競爭優勢。
而不同於中國激烈競爭,在南美國家等新興市場以及「一帶一路」周邊國家,生物類似葯市場是一片未經開發的「處女地」,存在大量未被滿足的臨床需求。一旦產品進入這些新興市場國家,市場規模有望翻倍,如果再進一步挺進歐美主流市場,則有望獲得7倍於中國市場的體量。
鑒於此,復宏漢霖針對HLX02做了大規模國際多中心(中國大陸、烏克蘭、波蘭和菲律賓)3期臨床試驗,還陸續通過與Accord、Cipla、Mabxience和雅各臣葯業等國際一流的生物製藥企業達成合作,促進HLX02在全球80多個國家和地區的商業化進程。
當年,對於一個初創公司而言,堅持為這樣的高標準買單並不容易。復宏漢霖生產基地建造和設計是依照歐盟質量標準,曲妥珠單抗HLX02從臨床前研究、臨床試驗等階段都要與原研葯進行頭對頭比較,開發周期長、成本高、國內行業標準尚不完善,都是當時面臨的困難。不過,也正是因為當時的堅持,復宏漢霖迎來了厚積薄發的「大年」。對質量的堅守也奠定了復宏漢霖最堅實的核心能力,助力其衝刺全球生物類似葯市場的黃金年代。
03 全球醫藥行業下一個金礦
生物類似葯被譽為「全球醫藥行業下一個金礦」。2018年全球銷售額排名前十的藥物中有9個都是生物葯,它們累計銷售額突破767.2億美金,2019年這一數字再創新高。
如此巨大的市場早已吸引了眾多製藥公司布局生物類似葯,而2015以來,市場上主要的生物藥專利已經或即將到期,給生物類似葯開發創造了前所未有的機遇。
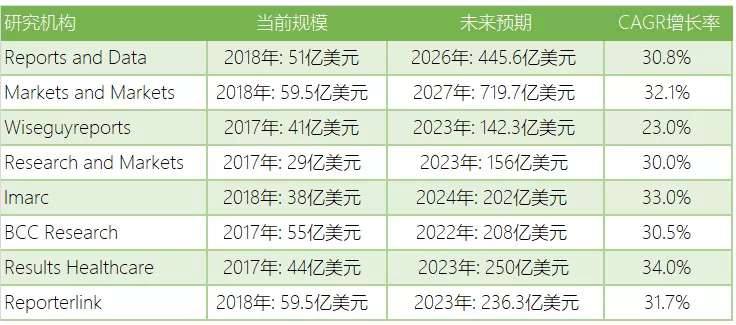
而各大研究機構都毫不吝嗇地預測了生物類似葯發展速度和規模,2024年將突破百億美元。其中Markets and Markets預測2027年這一市場將達到719.7億美元,CAGR增長率為31.1%。
而這一市場除了吸引傳統MNC巨頭、仿製葯巨頭和生物新貴企業入局,也吸引了資本的青睞。科睿唯安數據顯示,2015~2018年間有11家獲得融資的公司涉及生物類似葯業務,單筆總投資額最高達8.33億美元;2018年1月以來有78項交易涉及生物類似葯,最高交易金額達12億美金。
生物類似葯研發雖然競爭激烈,但門檻很高,同時頭部優勢很強。從數據來看,EMA批准的生物類似葯批文中集中度很高,前四家公司覆蓋了50%左右的批文。正因如此,一家生物製藥企業如果有產品通過EMA或FDA的核查,獲得主流市場的認可,該企業的價值將會被充分認知。這在國際上已有先例:2015年2月底,韓國Celltrion公司首個生物類似葯Remsima開始在歐洲上市銷售,此後公司股價接連上升,市盈率一度超過120。
而復宏漢霖的研發策略並不僅僅是生物類似葯,而是以生物類似葯為基礎打磨質量體系建設,逐步過渡到生物創新葯。
其中生物創新藥方面,抗PD-1單抗HLX10已相繼獲得美國、中國台灣及中國大陸的臨床試驗批准並正在全球陸續開展多個關鍵2/3期臨床試驗,單葯有望在2020年於中國報產。此外,復宏漢霖還積極布局海外市場,已經就HLX10在東南亞地區10個國家與KGbio達成獨家協議,並戰略規劃未來進軍美國、歐盟等國際市場。復宏漢霖已經具有接受歐盟核查的經驗,相信也將極大助力其未來進入歐美主流市場。
根據復宏漢霖官網顯示,除了已在中國上市的利妥昔單抗以及中歐雙報的HLX02,另外還有HLX03也獲得中國新葯上市申請受理。復宏漢霖還有10個產品、8個聯合治療方案在全球範圍內開展20多項臨床試驗,包括生物類似葯和生物創新葯。而已經完成歐盟GMP認證的復宏漢霖,憑藉一次次嘗試和學習所積累的經驗,將更多的生物葯帶到國際市場上市會變得越來越容易。
