9月25日至9月29日,第24屆全國臨床腫瘤學大會暨2021年CSCO學術年會以線上和線下相結合的形式召開。本屆大會,復宏漢霖創新PD-1抑制劑斯魯利單抗聯合HLX04(貝伐珠單抗生物類似藥)在晚期肝細胞癌患者中開展的II期臨床研究獲選創新專場,並以口頭報告形式首度發佈。目前斯魯利單抗「泛癌種」治療高度微衛星不穩定型(MSI-H)實體瘤適應症的上市註冊申請於2021年4月獲NMPA受理並被納入優先審評審批程序,有望於2022年上半年獲批上市。此外,斯魯利單抗鱗狀非小細胞肺癌適應症的上市註冊申請也正在審評中。
圍繞「Combo+Global」(聯合治療+國際化)差異化開發戰略,斯魯利單抗已獲得中國、美國、歐盟等國家及地區的臨床試驗許可,目前共開展10項腫瘤免疫療法臨床試驗,適應症廣泛覆蓋肺癌、肝細胞癌、食管癌、頭頸癌和胃癌等高發大癌種,全球範圍內累計入組約2300名受試者,也印證了國際市場對斯魯利單抗質量的信心與認可。
以下為斯魯利單抗治療聯合HLX04貝伐珠單抗晚期肝細胞癌的數據發表詳情:
論文題目:斯魯利單抗(HLX10,創新型抗PD-1單抗)聯合HLX04(貝伐珠單抗生物類似藥)在晚期肝細胞癌患者中開展的II期臨床研究(ID: 9949)
主要研究者:樊嘉,復旦大學附屬中山醫院;任正剛,復旦大學附屬中山醫院
展示形式:口頭報告
主講人:任正剛,復旦大學附屬中山醫院
匯報時間:2021.09.28 15:00–15:10,主會場,創新專場2(上海)
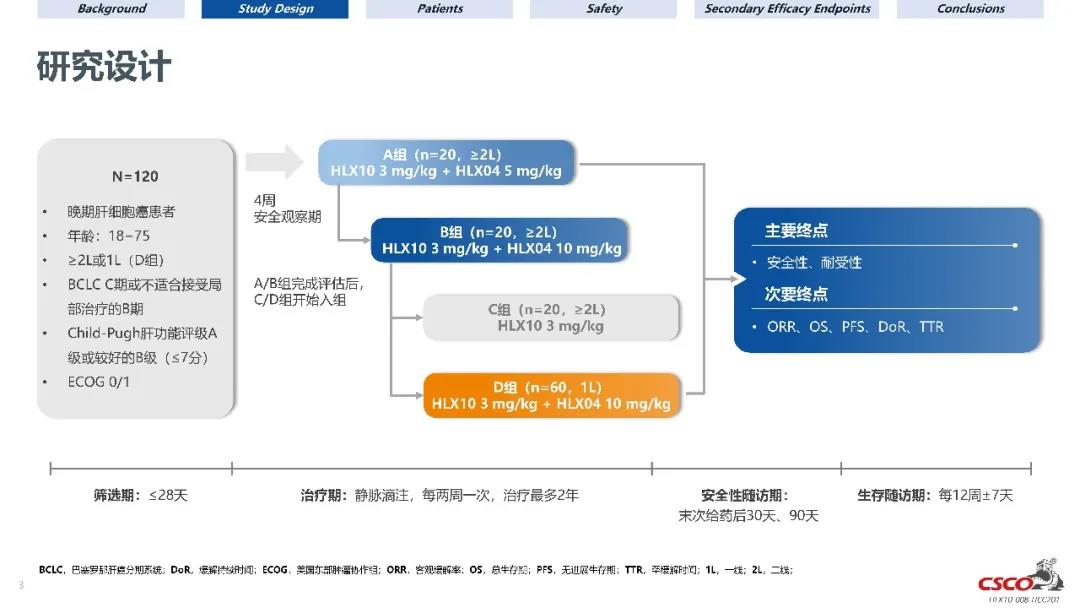
試驗設計
本研究是一項在晚期肝細胞癌患者中開展的旨在評估HLX10聯合HLX04的療效、安全性和耐受性的開放、多中心臨床2期研究。合格的受試者被納入四個試驗組。其中經標準治療後進展或不耐受的患者被納入A、B、C組,先前未經系統性治療的受試者被納入D組,分別每兩周靜脈輸注HLX10 3 mg/kg聯合HLX04 5 mg/kg、HLX10 3 mg/kg聯合HLX04 10 mg/kg、HLX10 3 mg/kg、HLX10 3 mg/kg聯合HLX04 10 mg/kg。終點包括獨立影像評估委員會(IRRC)和研究者根據RECIST v1.1標準評估客觀緩解率(ORR),總生存期(OS),無進展生存期(PFS),持續緩解時間(DoR)和安全性等。
試驗結果
有效性
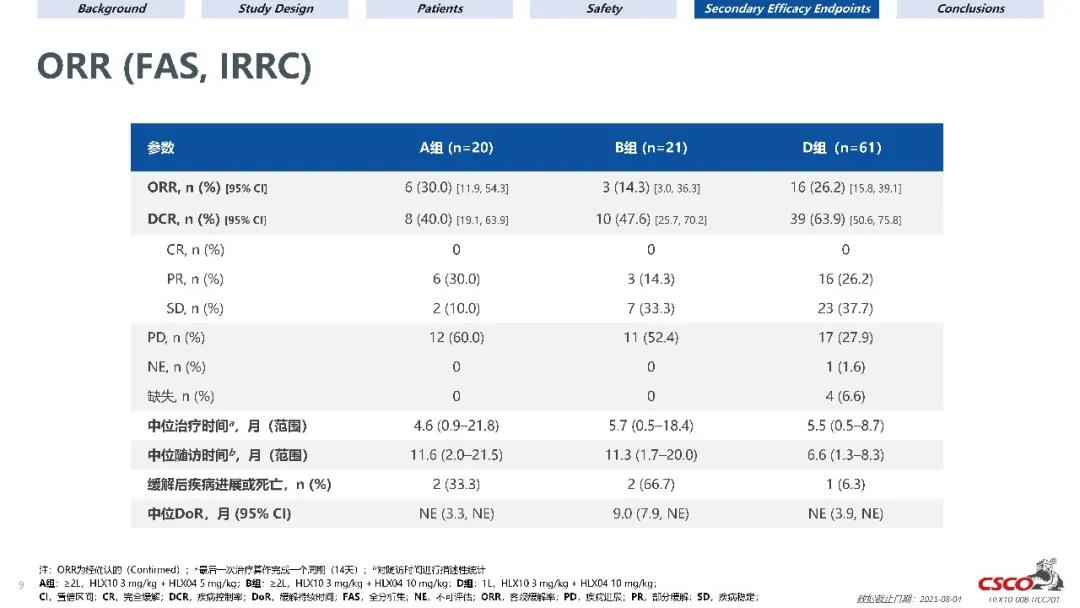
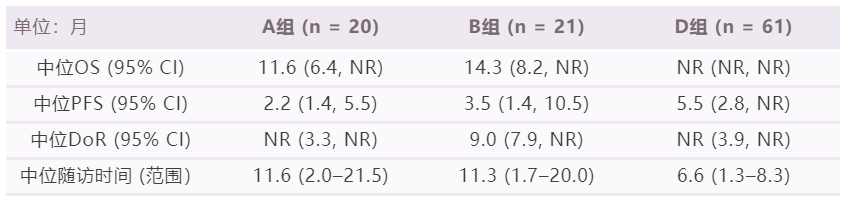
截止到2021年8月4日,由於C組的中位隨訪時間較短,本次僅披露A組(n = 20)、B組(n = 21)和D組(n = 61)的數據。A、B、D組經IRRC評估的ORR分別為30.0%(95% CI:11.9,54.3)、14.3%(95% CI:3.0,36.3)和26.2%(95% CI:15.8,39.1)。其他療效結果如下表所示。
安全性
結果表明,HLX10聯合HLX04具有良好的安全性和耐受性。
結論
試驗結果表明,HLX10聯合HLX04在晚期肝細胞癌患者中展現了顯著的抗腫瘤活性和較好的安全性,有望為此類患者提供一種新的治療選擇。