基於細胞的治療技術是指利用細胞(如免疫細胞、幹細胞等)作為活體製劑來治療疾病的技術。2017年,隨着兩款靶向CD19的CAR-T藥物先後被美國FDA批准上市,tisagenlecleucel用於治療急性淋巴細胞白血病(ALL)和axicabtagene ciloleucel用於治療大B細胞淋巴瘤(LBCL),過繼性細胞療法在醫藥市場上獲得了爆發性的關注,越來越多的企業加入了細胞治療的研發隊伍中。除了血液瘤之外,近期細胞療法也在其它適應症上獲批,例如使用自體衍生的角膜幹細胞修復受損的角膜上皮細胞[1]、利用幹細胞治療克羅恩病相關瘺管[2]等。
誘導多功能幹細胞(iPSC)來源的細胞療法具有可批量化生產通用型細胞的優勢,可降低成本、提前製備、隨取隨用,不少公司已着眼於該療法的開發,例如將iPSC NK細胞療法單用或與NK Engager協同,靶向殺傷腫瘤細胞,而IL-15信號的加入可促進NK細胞增殖、提高抗腫瘤活性[4]。另外,iPSC在眼病、神經系統疾病、代謝類疾病等非腫瘤疾病中的應用也在研究中,例如用iPSC來源的視網膜色素上皮細胞治療急性黃斑變性[5],用iPSC生成多巴胺能神經元治療帕金森[6],利用iPSC開發替代胰島B細胞的工程細胞以治療1型糖尿病[7]等。
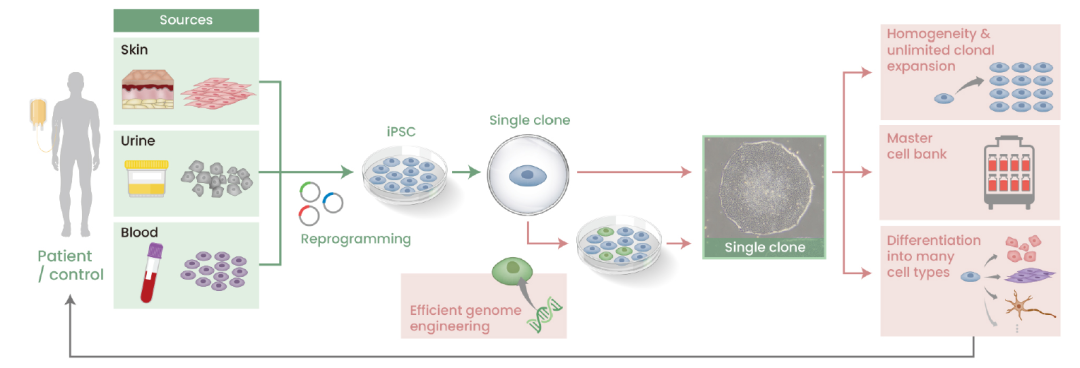
Application of iPSCs to regenerative medicine [4].
創新細胞工程技術助力細胞治療
基因編輯和表觀基因組編輯、合成生物學、生物材料等領域的發展,可助力細胞治療應對當前的挑戰,改善現有療法,或創建新的細胞治療管線。除少部分技術已成功用於商業化產品,目前大多數研究仍處於臨床前階段。
CRISPR-Cas基因編輯系統在特定位點製造DNA雙鏈斷裂(DSBs),經過細胞自發的修復機制(如NHEJ,HDR等),可對單個位點甚至多個位點實現基因編輯。在一項研究中,科學家使用慢病毒遞送Cas9 mRNA和gRNA,同時敲除T細胞受體(TCR)、β2-微球蛋白(β2m)和PD1基因,可製造缺乏TCR、HLA I分子和PD1的同種異體通用型CAR-T細胞,這種經過基因編輯的CAR-T細胞免疫原性降低、生存能力提高,且PD1基因的敲除使其具有更強的抗腫瘤活性,可增加臨床使用時的安全性和有效性[8]。
合成生物學通過應用定量設計規則,可使基因工程更加精確、可預測和可重複,例如精確控制治療性轉基因的表達、細胞分泌的治療因子的傳遞,或對細胞進行編程後,使其具有特殊的感知和反應能力,感知組織相關或疾病狀態相關的分子並改變細胞行為,這些改造可增強細胞治療的效果。
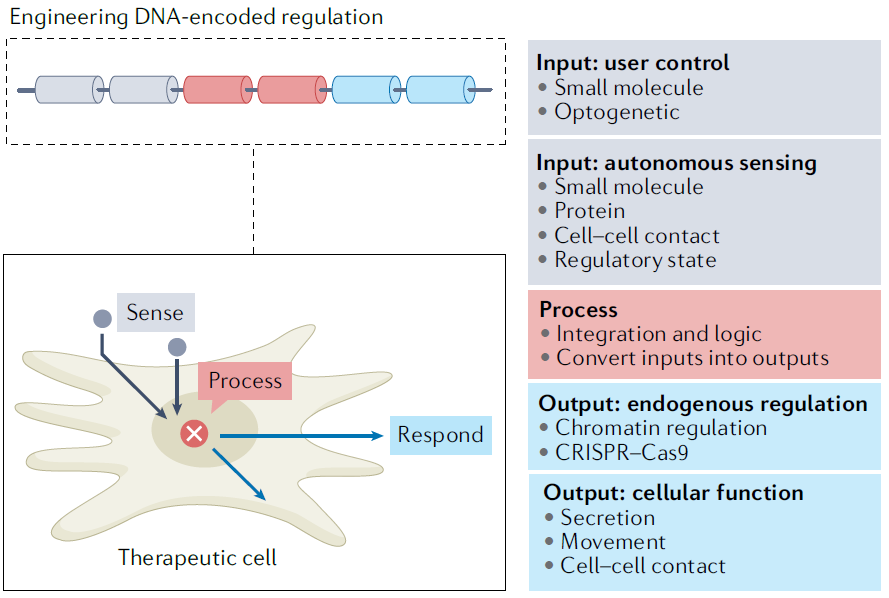
Using synthetic biology approaches to endow therapeutic cells with enhanced functional properties[3]
生物材料的使用(半滲透性生物材料、水凝膠等)可輔助治療用細胞的遞送,保證其生物活性和安全性。當前研究的重點在於開發長效的功能性免疫分離技術,保護治療用細胞免受人體免疫細胞的排異,以實現異體細胞的使用。對異體細胞排異反應的產生需經過細胞間的接觸,因此用半滲透性材料將治療用異體細胞進行封裝是一種應對策略,這種封裝需考慮異體細胞與外界的雙向物質交換,例如從外界流入葡萄糖、氧氣等養分以維持細胞生命,從內部流出工程細胞產生的治療性蛋白分子。生物材料細胞封裝技術已在腫瘤、內分泌、神經內分泌、眼科疾病等領域開展臨床評估,但其中一個挑戰在於,免疫細胞對這些生物材料的排異反應會使材料內部逐漸產生纖維化和缺氧問題,難以實現長期有效的治療效果。面對該挑戰,科學家正在嘗試使用海藻酸基水凝膠、ultra-low-fouling兩性離子生物材料等新型材料,並在動物實驗中觀察到了積極的結果[3]。
結語
為了應對來自真實世界的挑戰,讓更多患者能夠通過細胞治療這一途徑解決以往難以治療的疾病,現存的細胞治療技術亟需進一步改進和創新升級。更強靶向性、更具安全性、以及通用「現貨型」的細胞治療產品已經在路上,我們期待更多新材料、新技術和創新治療策略,能夠解決更多未滿足的臨床痛點。復宏漢霖2022火星登陸計劃,期待有志之士的加入!
參考文獻
[1] Pellegrini, G. et al. Navigating market authorization: the path holoclar took to become the first stem cell product approved in the European Union. Stem Cell Transl. Med. 7, 146–154 (2018).
[2] Buscail, E. et al. Adipose- derived stem cells in the treatment of perianal fistulas in Crohn’s disease: rationale, clinical results and perspectives. Int. J. Mol. Sci. 22, 9967 (2021).
[3] Bashor, C.J., Hilton, I.B., Bandukwala, H. et al. Engineering the next generation of cell-based therapeutics. Nat Rev Drug Discov (2022). https://doi.org/10.1038/s41573-022-00476-6
[4] Karagiannis P, Kim SI. iPSC-Derived Natural Killer Cells for Cancer Immunotherapy. Mol Cells. 2021 Aug 31;44(8):541-548.
[5] da Cruz, L. et al. Phase 1 clinical study of an embryonic stem cell- derived retinal pigment epithelium patch in age- related macular degeneration. Nat. Biotechnol. 36, 328–337 (2018).
[6] Osborn, T. M., Hallett, P. J., Schumacher, J. M. & Isacson, O. Advantages and recent developments of autologous cell therapy for Parkinson’s disease patients. Front. Cell Neurosci. 14, 58 (2020).
[7] Drew, L. How stem cells could fix type 1 diabetes. Nature 595, S64–S66 (2021).
[8] Ren, J. et al. Multiplex genome editing to generate universal CAR T cells resistant to PD1 inhibition. Clin. Cancer Res. 23, 2255–2266 (2017).
