2024年1月17日,復宏漢霖(2696.HK)宣布,公司兩項創新藥最新臨床研究結果以壁報形式入選2024年美國臨床腫瘤學會胃腸道腫瘤研討會(ASCO GI),分別是由中山大學腫瘤防治中心徐瑞華教授擔任主要研究者的H藥漢斯狀®(斯魯利單抗)聯合漢貝泰®(HLX04,貝伐珠單抗)和化療用於一線治療轉移性結直腸癌(mCRC)的II/III期臨床研究(HLX10-015-CRC301),以及由上海市東方醫院李進教授擔任主要研究者的創新型抗HER2單抗HLX22聯合漢曲優®(曲妥珠單抗,歐洲商品名:Zercepac®,澳大利亞商品名:Tuzucip®和Trastucip®)和化療用於一線治療HER2陽性局部晚期或轉移性胃/胃食管交界部(G/GEJ)癌的II期臨床研究(HLX22-GC-201)。
HLX10-015-CRC301研究
結腸直腸癌(CRC)是全球最常見的惡性腫瘤之一。據GLOBOCAN數據顯示,2020年全球約有超過190萬新發病例,死亡病例逾90萬例[1]。mCRC的標準一線治療包括血管內皮生長因子(VEGF)抑制劑(如貝伐珠單抗)聯用化療[2-4],但持續療效和預後仍有待進一步改善。此前,斯魯利單抗憑藉良好的研究數據已於2022年3月獲批用於治療微衛星高度不穩定(MSI-H)實體瘤並被納入《CSCO結直腸癌診療指南(2023版)》和《CSCO免疫檢查點抑制劑臨床應用指南(2023版)》。復宏漢霖通過HLX10-015-CRC301研究進一步開展免疫療法探索,希望為更多結直腸癌患者提供更有效的治療方法。該研究結果顯示,H藥聯合漢貝泰®和化療顯著改善未經治療的mCRC患者生存期,且安全性可控。
HLX22-GC-201研究
胃/胃食管交界部(G/GEJ)癌的治療是一個全球性的挑戰。據GLOBOCAN數據顯示,2020年全球約有超過100萬新發病例[1]。多數G/GEJ癌患者確診時已處於疾病晚期,總體預後不良,5年相對生存率僅為6%[5,6],這其中HER2陽性患者的預後曾較HER2陰性患者更差[5,7]。HLX22為復宏漢霖自AbClon, Inc.許可引進、並後續自主研發的靶向HER2的創新型單克隆抗體。與曲妥珠單抗類似,HLX22可結合在HER2的亞結構域IV,但結合表位與曲妥珠單抗有所不同,使得HLX22和曲妥珠單抗能夠同時與HER2結合,從而產生更強的HER2受體阻斷效果。臨床前研究表明,HLX22與曲妥珠單抗聯合治療可抑制表皮生長因子(EGF)和HRG1(Histidine-Rich Glycoprotein 1)誘導的細胞增殖,增強體外和體內的抗腫瘤活性,且HLX22的I期臨床試驗證實產品安全且可耐受。HLX22-GC-201研究結果顯示,在HLX02 + XELOX的基礎上加入HLX22可提高HER2陽性G/GEJ癌患者一線治療的生存期和抗腫瘤反應,且安全性可控。目前,全球尚無同類用於治療HER2陽性胃癌的HER2雙靶點療法獲批准上市。
此次ASCO GI公布的數據詳情如下:
摘要標題:
斯魯利單抗聯合HLX04和XELOX對比安慰劑聯合貝伐珠單抗和XELOX一線治療轉移性結直腸癌:一項II/III期研究
試驗設計:
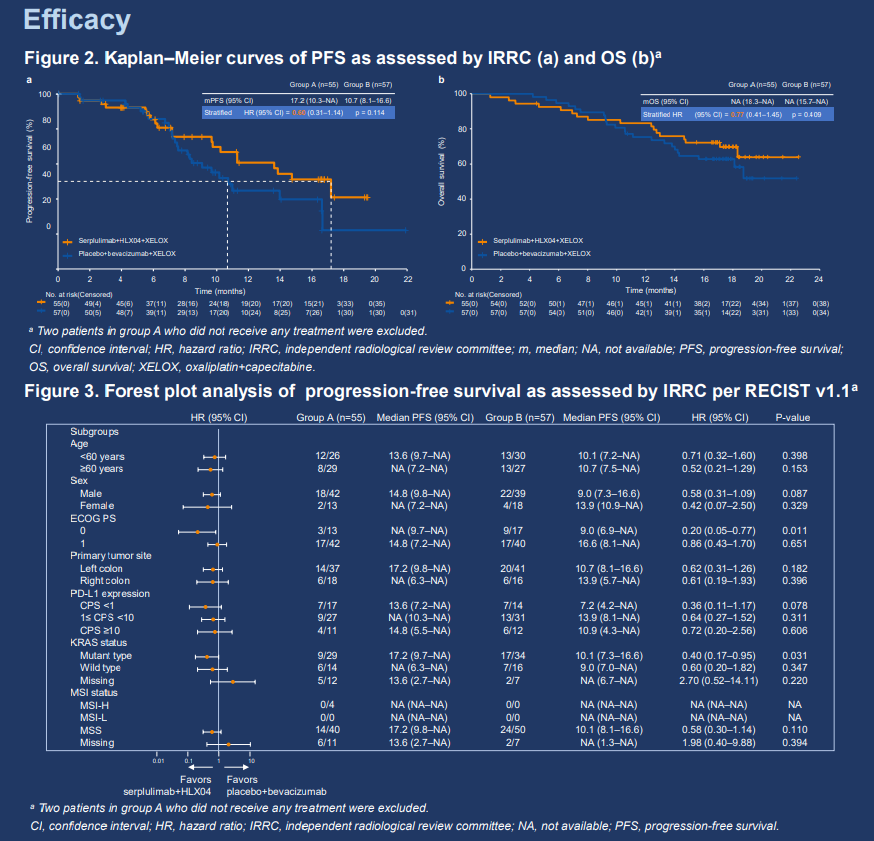
這是一項隨機、雙盲、多中心的II/III期研究;此次將側重於介紹II期部分。既往未接受過系統性治療的不可切除轉移性/復發性結直腸腺癌患者按1:1的比例隨機分組,分別接受斯魯利單抗(300 mg,Q3W IV)聯合HLX04(貝伐珠單抗,7.5 mg/kg,Q3W IV)和XELOX(A組)或安慰劑聯合貝伐珠單抗和XELOX(B組)治療。隨機化按PD-L1表達水平(CPS <1 vs. 1≤ CPS <50 vs. CPS ≥50)、ECOG PS評分(0 vs. 1)和原發腫瘤部位(左側 vs. 右側)進行分層。主要終點是IRRC根據RECIST 1.1評估的PFS。次要終點包括其他療效終點、安全性、藥代動力學、生物標誌物探索和生活質量評估。
結果:
2021年7月16日至2022年1月20日,本試驗共入組並隨機分配114例患者(A組,n = 57;B組,n = 57)。其中83(72.8%)例為男性。所有患者均患有IV期結直腸癌(CRC)。94例有MSI狀態評估結果的患者中有90(95.7%)例為MSS。本報告將重點介紹研究藥物在接受了給藥的患者(A組,n = 55;B組,n = 57)即調整的意向性治療人群中的療效和安全性。截至2023年6月1日(數據截止日期),中位隨訪時間為17.7個月。與B組相比,A組的IRRC評估的中位PFS明顯更長(17.2 vs. 10.7個月;分層HR 0.60,95% CI 0.31–1.14)。兩組的中位OS均未達到(分層HR 0.77,95% CI 0.41–1.45)。A組和B組各有36(65.5%)例患者和32(56.1%)例患者出現≥3級治療相關不良事件,最常見的3級及以上治療相關不良事件為中性粒細胞計數降低(21.8% vs. 10.5%)和血小板計數降低(16.4% vs. 10.5%)。A組和B組各有5(9.1%)例患者和1(1.8%)例患者發生了≥3級免疫相關不良事件。A組和B組各有4(7.3%)例患者和3(5.3%)例患者發生了治療相關死亡。
結論:
與安慰劑聯合貝伐珠單抗和XELOX相比,斯魯利單抗聯合HLX04和XELOX明顯延長了PFS,改善了其他療效終點,且安全性可控。斯魯利單抗聯合HLX04和XELOX是一種有前景的轉移性CRC患者一線治療方案,值得進一步研究。
————————————————————————————————————————————
摘要標題:
HLX22聯合HLX02和XELOX一線治療HER2陽性局部晚期或轉移性胃/胃食管交界部癌:一項隨機、雙盲、多中心II期研究
試驗設計:
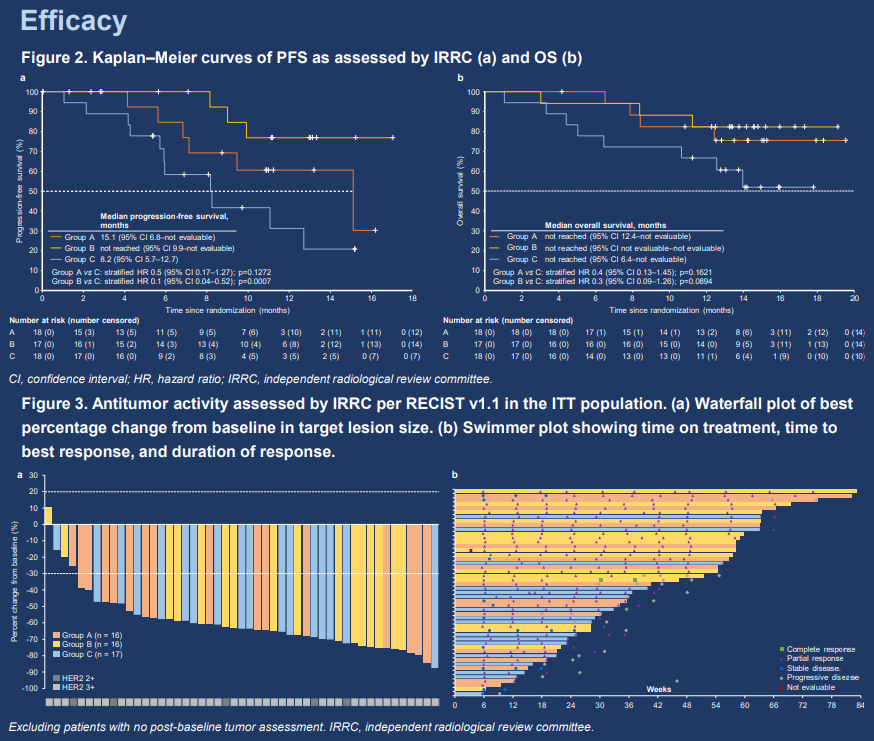
本研究在最後一例患者入組3個月後揭盲。入組的患者為既往未接受過系統性抗腫瘤治療的局部晚期或轉移性HER2陽性胃/胃食管交界部(G/GEJ)癌患者。研究分為兩個部分,本報告將側重於介紹第一部分。在第一部分中,患者按1:1:1的比例隨機分組,分別接受HLX22(創新型抗HER2單抗)25 mg/kg + HLX02(曲妥珠單抗)+ XELOX(A組)、HLX22 15 mg/kg + HLX02 + XELOX(B組)或安慰劑 + HLX02 + XELOX(C組)治療,每3周為一個周期。主要終點是由IRRC根據RECIST v1.1評估的PFS和ORR。次要終點包括其他療效指標和安全性。
結果:
截至2023年7月30日(數據截止日期),53例患者被隨機分配至A組(n = 18)、B組(n = 17)和C組(n = 18),中位隨訪時間為14.3個月。44(83.0%)例患者為男性。主要療效結果見表1。表1中報告的腫瘤評估由IRRC進行。各組分別有18(100.0%)例、16(94.1%)例和17(94.4%)例患者發生治療相關不良事件(TRAE)。A組、B組和C組各有5(27.8%)例、1(5.9%)例和1(5.6%)例患者發生嚴重TRAE。僅C組有1(5.6%)例患者報告了5級TRAE。
結論:
在HLX02 + XELOX的基礎上加入HLX22可提高HER2陽性G/GEJ癌患者一線治療的生存期和抗腫瘤反應,且安全性可控。
表1. 療效結果
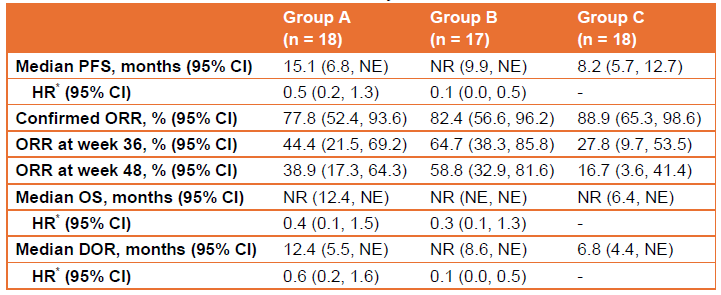
*對A組和C組之間以及B組和C組之間的風險比(HR)進行估算。
NE,不可評估;NR,未達到。
【參考文獻】
[1] Sung H. et al. CA Cancer J Clin 2021;71(3):209-49.
[2] Iwasa, S. et al. Cancer Commun (Lond) 43, 519-522 (2023).
[3] Hurwitz, H. et al. N Engl J Med 350, 2335-2342 (2004).
[4] Benson, A. B. et al. J Natl Compr Canc Netw 20, 1139-1167 (2022).
[5] Ajani JA. et al. J Natl Compr Canc Netw 2022;20(2):167-92.
[6] Alsina M. et al. Nat Rev Gastroenterol Hepatol 2023;20(3):155-70.
[7] Gravalos C. et al. Ann Oncol 2008;19(9):1523-9.
