2024年4月10日,復宏漢霖(2696.HK)宣布,公司首個創新型單抗H藥 漢斯狀®(斯魯利單抗)一線治療廣泛期小細胞肺癌(ES-SCLC)的國際多中心III期臨床試驗ASTRUM-005的探索性生物標誌物分析數據在2024年美國癌症協會年會(AACR 2024)上以壁報形式展示,該研究的主要研究者為吉林省腫瘤醫院程穎教授。
H 藥為復宏漢霖自主研發的重組人源化抗PD-1單抗注射液,也是全球首個且目前唯一獲批一線治療小細胞肺癌的抗PD-1單抗,已在中國和印尼獲批上市,成為首個在東南亞國家成功獲批上市的國產抗PD-1單抗。自2022年3月首次獲批以來,H藥已累計批准用於治療微衛星高度不穩定(MSI-H)實體瘤、鱗狀非小細胞肺癌、ES-SCLC和食管鱗狀細胞癌4項適應症,惠及患者超過6萬人。此外,H藥聯合化療一線治療非鱗狀非小細胞肺癌(nsNSCLC)和一線治療廣泛期小細胞肺癌(ES-SCLC)的上市申請也分別獲得中國NMPA和歐盟EMA受理,同時,公司於泰國、新加坡、馬來西亞等國家遞交了H藥的上市許可申請,進一步推動H藥在東南亞地區的上市進程。公司亦穩步推進H藥對比一線標準治療阿替利珠單抗用於治療ES-SCLC的頭對頭美國橋接試驗,計劃於2024年在美國遞交上市許可申請(BLA)。
其中,H藥ES-SCLC適應症的獲批主要基於一項關鍵性臨床研究ASTRUM-005(NCT04063163)。該研究為一項隨機、雙盲、國際多中心的III期臨床試驗,旨在研究斯魯利單抗對比安慰劑分別聯合化療一線治療廣泛期小細胞肺癌(ES-SCLC)的療效和安全性。該研究結果於2022年ASCO年會上由程穎教授首次報告,並於2022年9月登頂全球四大頂級醫學期刊之一的《美國醫學會雜誌》(JAMA),隨後,其數據更新於2022年歐洲腫瘤學會亞洲分會(ESMO Asia)年會上發布。ASTRUM-005研究結果表明,該研究中患者的PD-L1腫瘤陽性比例評分TPS≥1%與其能否從H藥 斯魯利單抗聯合化療中獲益無直接關聯。為進一步探究該研究中能夠從H藥獲益的ES-SCLC患者的生物學特徵,復宏漢霖進行了探索性生物標誌物分析,回顧性地評估了H藥的療效與蛋白組特徵、基因突變及血液學指標間的關係。
以下為此次大會公布的數據詳情:
論文題目
Exploratory biomarker analysis of phase 3 ASTRUM-005 study: Serplulimab versus placebo plus chemotherapy for extensive-stage small cell lung cancer
國際多中心III期臨床試驗ASTRUM-005的探索性生物標誌物分析:斯魯利單抗聯合化療對比安慰劑用於廣泛期小細胞肺癌(ES-SCLC)一線治療
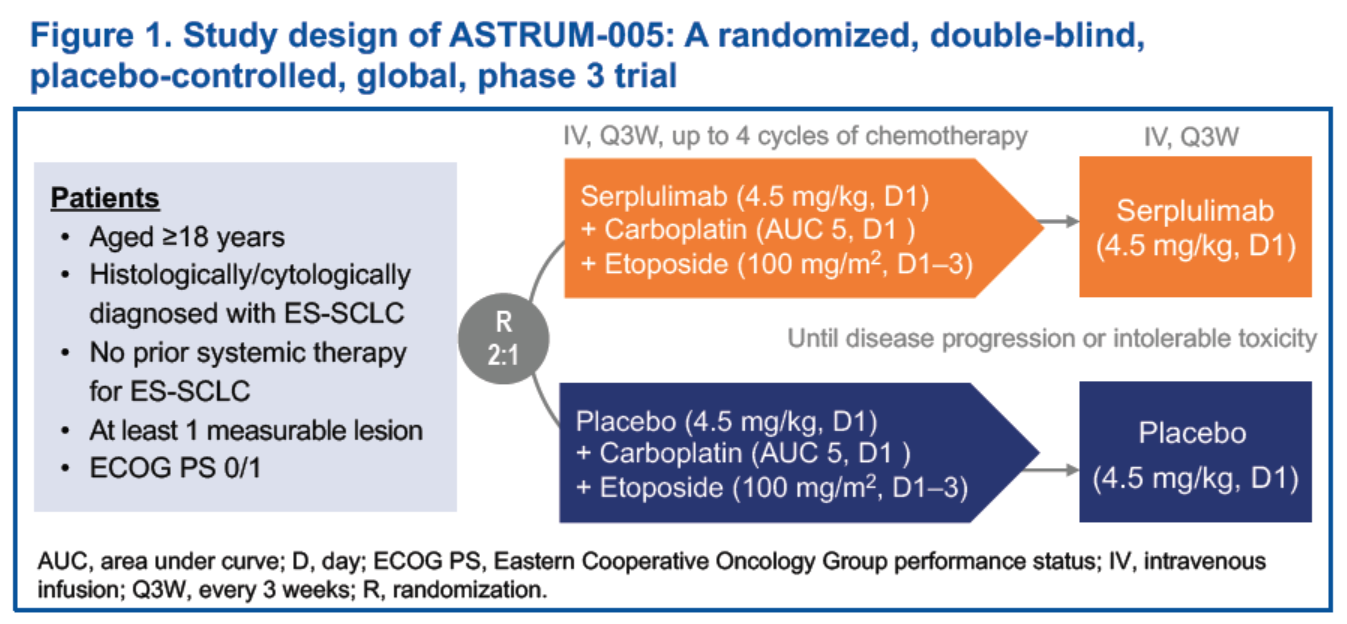
試驗設計
ASTRUM-005研究的生物標誌物分析
人群主要納入標準包括:①≥18周歲,②經組織學/細胞學確診的ES-SCLC患者,③之前沒有接受過系統性治療,④至少有一個可測量的病灶,⑤ECOG 活動狀態(PS)評分為0或1分。患者按照2:1的比例隨機分配至實驗組和對照組,兩組治療方案分別為斯魯利單抗或安慰劑(4.5mg/kg,D1)+ 卡鉑(AUC 5,D1)+ 依託泊苷(100 mg/m2,D1-3),靜脈輸注,每 3 周一次,最多4個治療周期,序貫斯魯利單抗(4.5 mg/kg,D1,3周1次)維持治療,直至疾病進展或不可耐受的毒性。
本研究對患者的蛋白組學、基因組學以及血液學指標與治療療效之間的相關性進行了分析。蛋白組學和基因組學檢測在中心實驗室進行,分別採集患者的血清樣本,通過 Olink® Explore 3072 平台進行蛋白組學檢測,採集腫瘤組織樣本提取DNA經 Med1CDxTM panel進行高通量測序分析基因突變。血液學檢測在研究中心進行,納入分析的指標包括中性粒細胞與淋巴細胞比值(NLR)、血小板與淋巴細胞比值(PLR)和乳酸脫氫酶(LDH)水平等。
統計分析
客觀緩解率(ORR)採用 Clopper-Pearson 法計算出95% 置信區間(CI),並用Cochran-Mantel-Haenszel 法計算OR值及其 95%置信區間(CI)。無進展生存期(PFS)和總生存期(OS)的中位值採用Kaplan-Meier法計算得出,n為每個亞組類別的患者人數。風險比及其95%置信區間採用未分層Cox 比例風險模型計算,並列值採用Efron 方法處理。
對於血清蛋白組學數據,首先採用t檢驗法確定治療組中疾病緩解者(包括完全緩解和部分緩解)和未緩解者(包括疾病穩定和疾病進展)的差異表達蛋白(differential expression protein, DEP),然後進一步通過廣義線性模型確認預測性/預後生物標誌物,並進5倍交叉驗證。
對於血液學指標,採用 X-tile法確定每個生物標誌物對應的最佳臨界值[1]。並進一步採用多變量 Cox 回歸模型確定獨立的生物標誌物。
臨床療效數據截止時間為2022年6月13日。
試驗結果
血清蛋白組
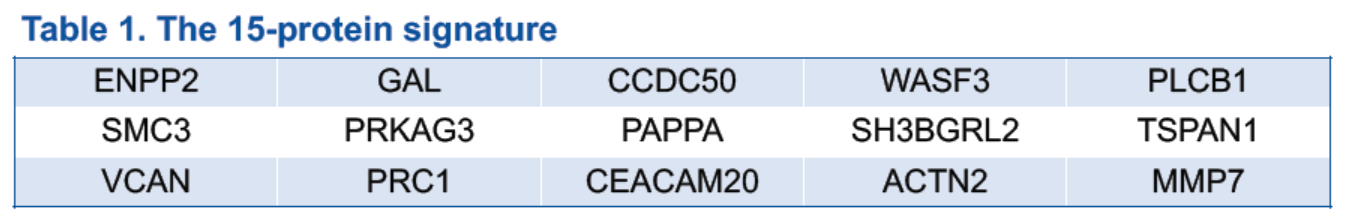
蛋白組分析結果收集自168名患者,其中斯魯利單抗給藥組128人,安慰劑組40人。通過對斯魯利單抗給藥組中緩解者和未緩解者的蛋白組圖譜進行比較,確定了181個DEP。為了進一步篩選生物標誌物蛋白,研究者將患者分為訓練集(斯魯利單抗給藥組80人)和驗證集(斯魯利單抗給藥組48人,安慰劑組40人)。並用廣義線性模型選擇和 5 倍驗證,篩選出一組基於15個蛋白表達的分子標籤(15-蛋白標籤)(表1),能夠最大化預測斯魯利單抗給藥組中的緩解者和未緩解者。
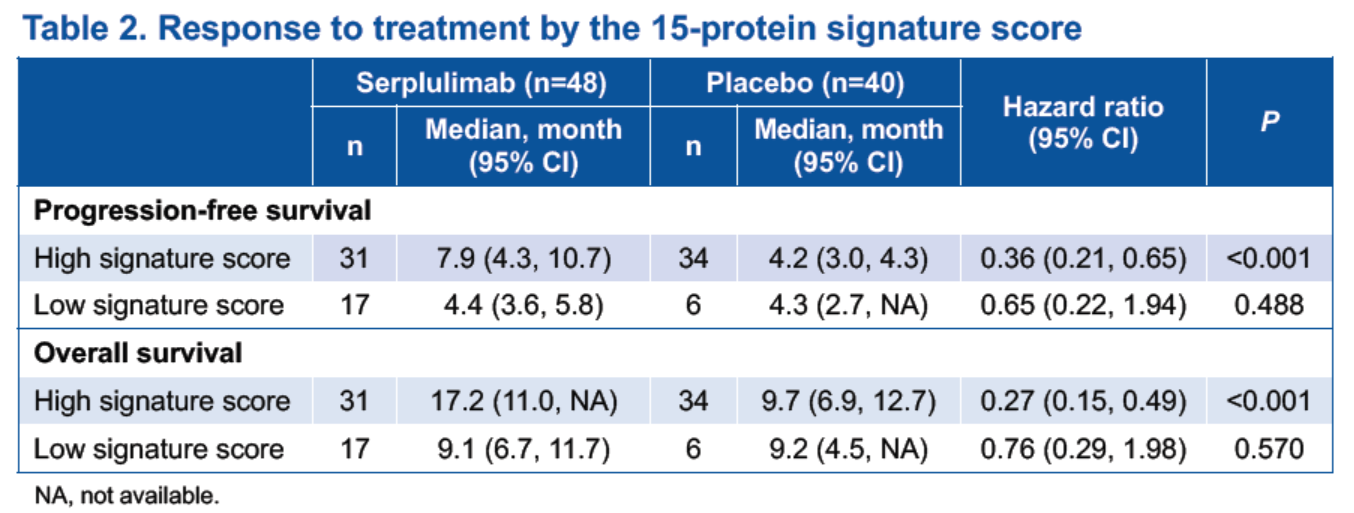
根據15-蛋白標籤建立的預測模型在訓練集上的AUC為0.982,在驗證集上斯魯利單抗給藥組和安慰劑組的AUC分別為0.918和0.545。在15-蛋白標籤的驗證集中,綜合評分較高的患者使用斯魯利單抗聯合化療相比於化療單藥,在PFS和OS方面獲益更為顯著(表2&圖2)。
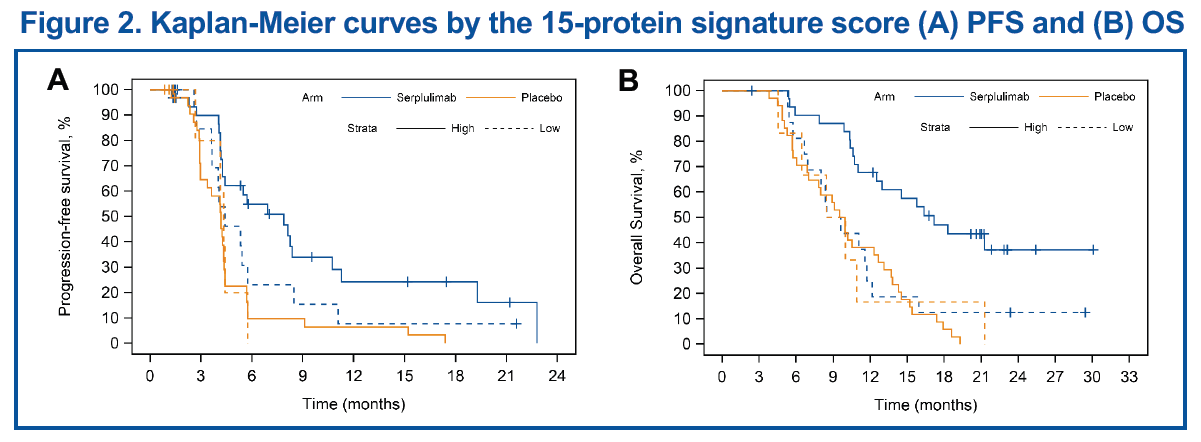
基因組突變
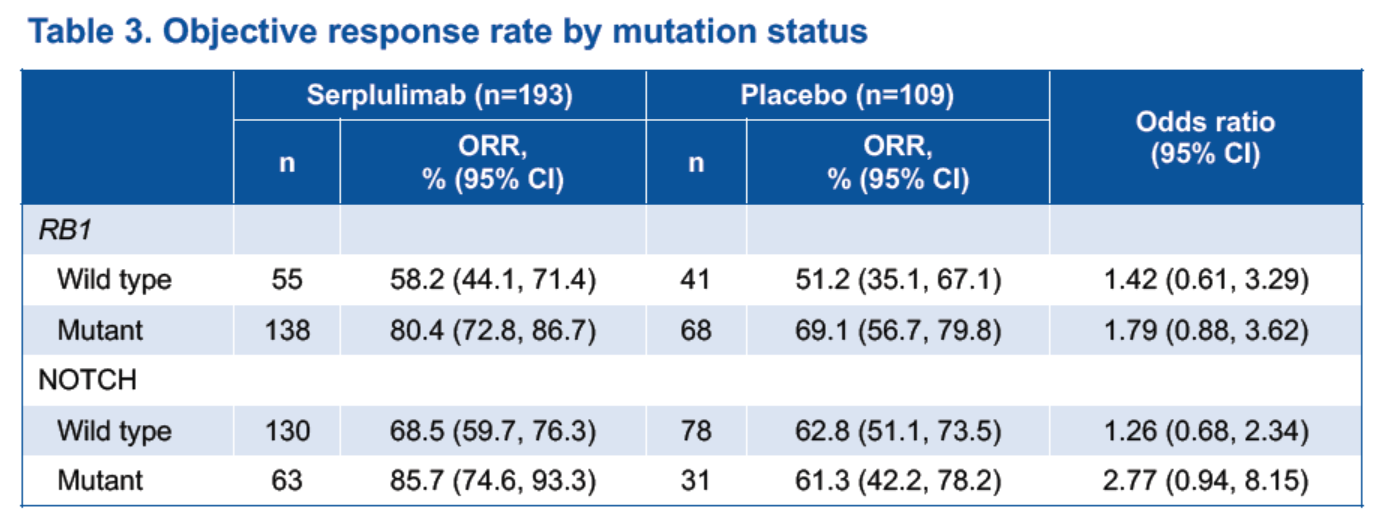
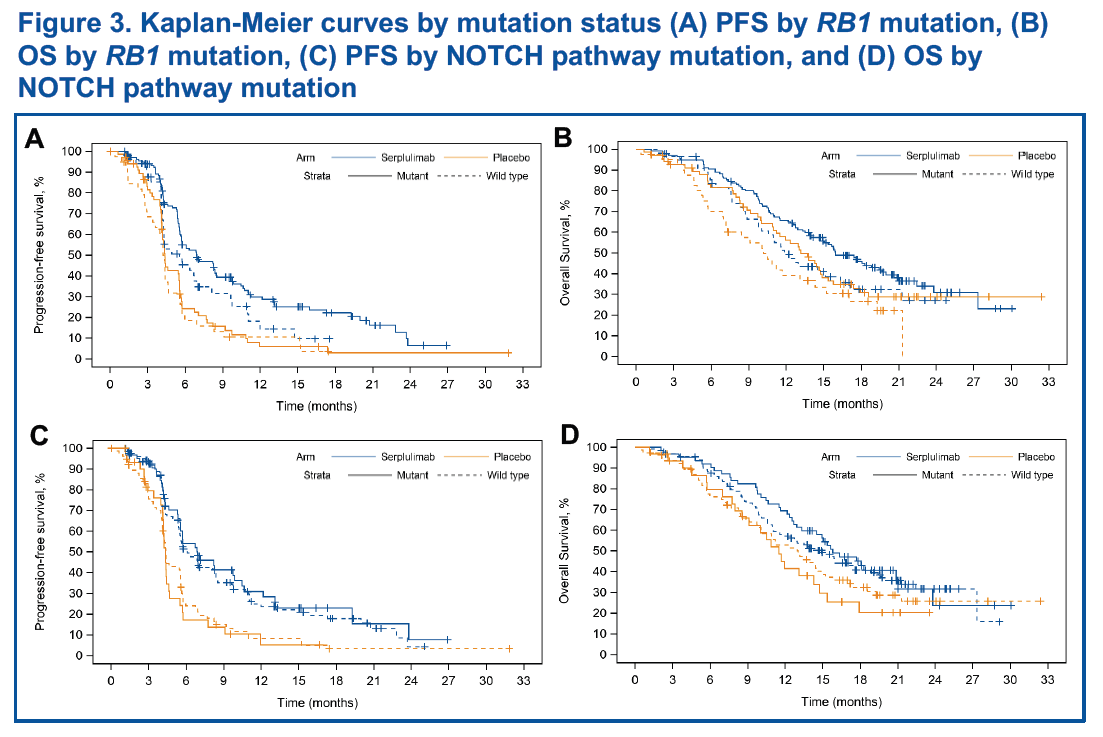
共有 305 例患者基因突變數據,排除 3 例異常值後,有 302 例患者的數據被納入分析。研究發現,RB1基因或NOTCH通路突變的患者相比較於沒有對應突變的患者,對斯魯利單抗聯合化療的應答率更高(表3),RB1基因突變的患者接受斯魯利單抗聯合化療能獲得更長的PFS和OS(圖3)。
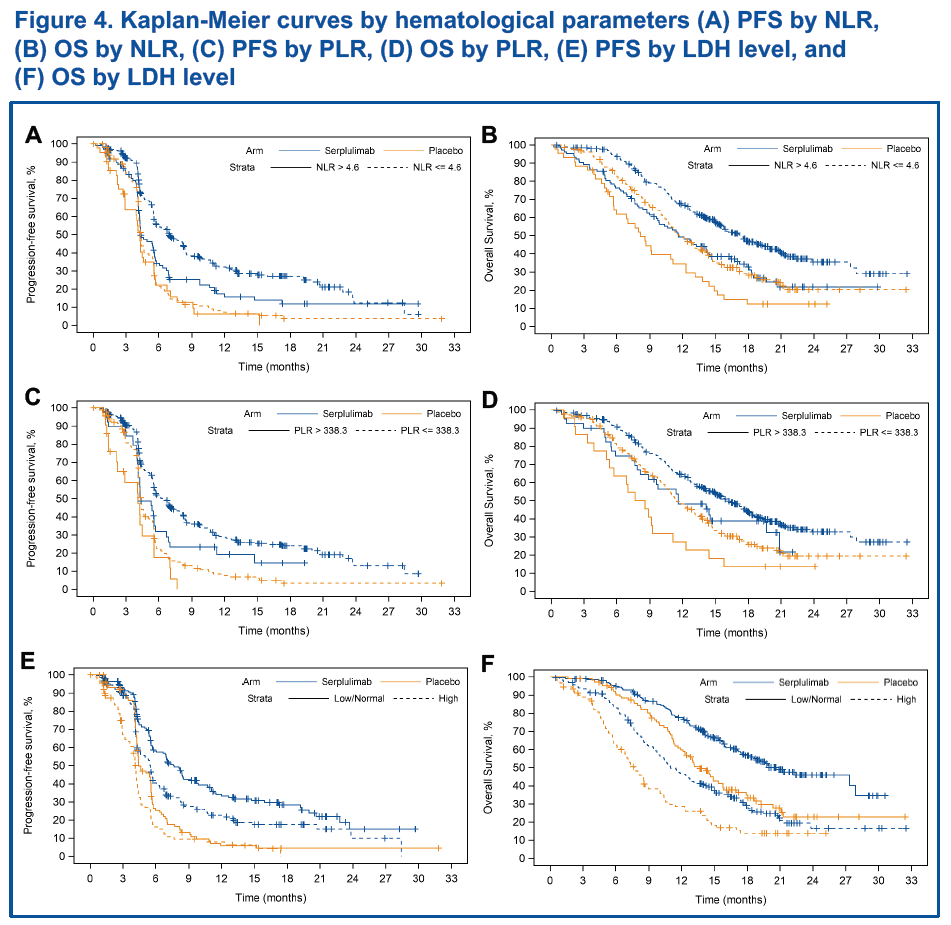
血液學參數
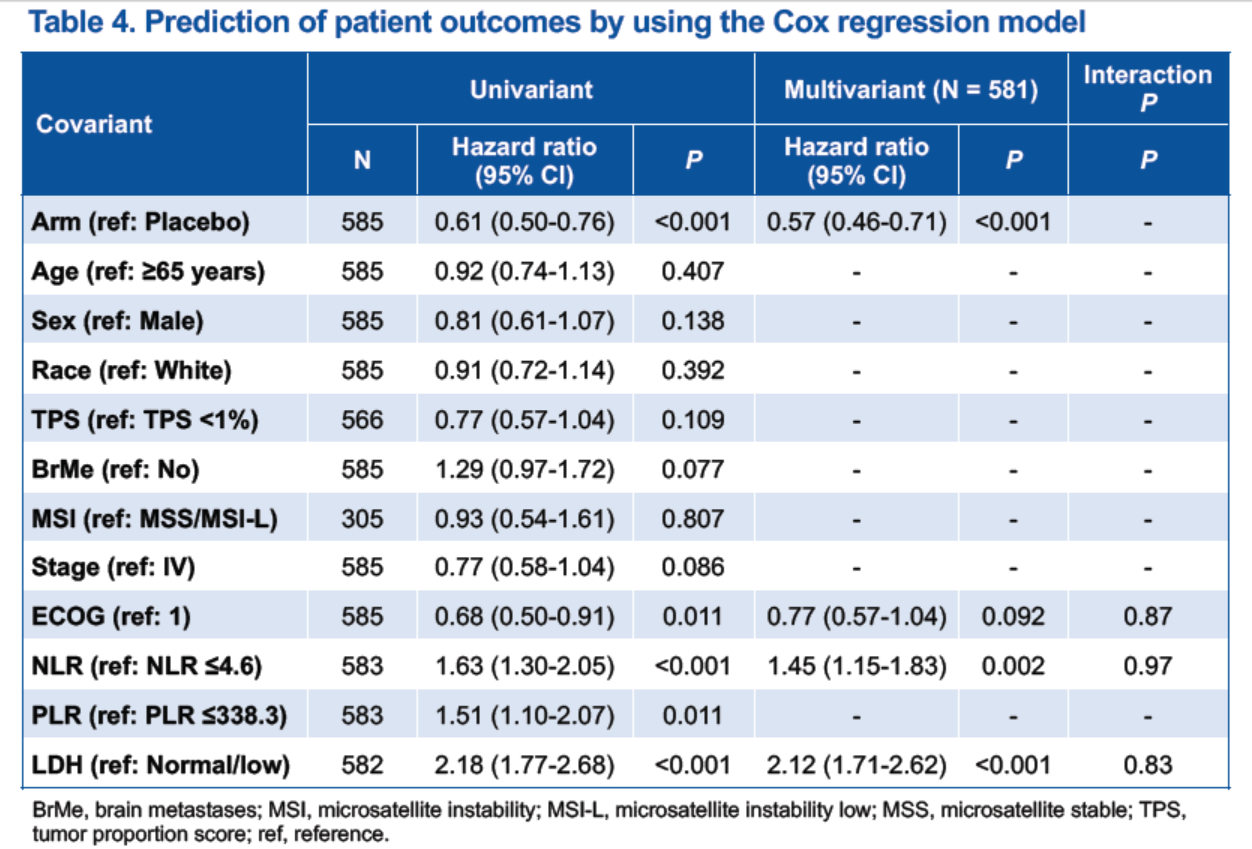
585名患者中,583名患者NLR 和 PLR檢測結果有效,582名患者LDH檢測結果有效。數據分析表明,無論治療方式如何,較高的基線NLR、PLR、和 LDH水平都和較短的PFS和OS相關(圖4),提示它們是小細胞肺癌的預後性生物標誌物,和患者的不良預後相關。
在單變量Cox回歸模型中,NLR、PLR和 LDH水平均和小細胞肺癌的治療結局相關,多變量 Cox 回歸模型顯示,僅基線 NLR 和 LDH 水平是獨立的預後性生物標誌物(表4)。
結論
目前,已有數個ES-SCLC免疫聯合化療的研究藥物獲批,但尚無明確的預測性生物標誌物,找到ES-SCLC患者對免疫聯合化療的生物標誌物對於了解小細胞肺癌患者對免疫治療的優勢人群的生物學特徵,從而進一步改善小細胞肺癌患者的生存十分重要。
我們的研究結果表明,上述15-蛋白分子標籤可作為預測性生物標誌物,提示患者接受斯魯利單抗聯合化療的治療效果。在基因突變層面,我們發現RB1基因突變或NOTCH通路突變患者可能從斯魯利單抗聯合化療中獲得更高的獲益,由於樣本量有限,以上結果還需臨床研究的進一步驗證。此外,和既往研究結果相似,我們發現NLR和LDH是ES-SCLC患者的獨立的預後生物標誌物,基線NLR或LDH水平高的患者的預後更差,有待進一步臨床研究的探索。
參考文獻
1. Camp R L, et al. Clin Cancer Res. 2004;10:7252–7259.
關於H藥 漢斯狀®
H藥 漢斯狀®為重組人源化抗PD-1單抗注射液(通用名:斯魯利單抗注射液),是全球首個獲批一線治療小細胞肺癌的抗PD-1單抗,已在中國和印度尼西亞獲批上市。截至目前,H藥已有4項適應症獲批上市,2項適應症上市申請分別在中國和歐盟獲受理,10餘項臨床試驗同步在全球開展。
2022年3月,H藥正式於中國獲批上市,目前可用於治療微衛星高度不穩定(MSI-H)實體瘤、鱗狀非小細胞肺癌(sqNSCLC)、廣泛期小細胞肺癌(ES-SCLC)及食管鱗狀細胞癌(ESCC)。H藥聯合化療一線治療非鱗狀非小細胞肺癌(nsNSCLC)和一線治療廣泛期小細胞肺癌(ES-SCLC)的上市申請也分別獲得中國NMPA和歐盟EMA受理。聚焦肺癌和消化道腫瘤,復宏漢霖積極推進H藥與公司其他產品的協同以及與創新療法的聯合,在全球同步開展10餘項腫瘤免疫聯合療法臨床試驗,於中國、美國、土耳其、波蘭、格魯吉亞等國家和地區累計入組超3900人。H藥的4項關鍵性臨床研究結果分別發表於知名期刊《美國醫學會雜誌》(JAMA)、《自然-醫學》(Nature Medicine)、Cancer Cell和British Journal of Cancer。此外,H藥還榮獲《CSCO 小細胞肺癌診療指南》、《CSCO非小細胞肺癌診療指南》、《CSCO 食管癌診療指南》、《CSCO結直腸癌診療指南》、《CSCO免疫檢查點抑制劑臨床應用指南》和《中國食管癌放射治療指南》等多部權威指南推薦,為腫瘤臨床診療提供重要參考。海外方面,H藥治療SCLC也已獲得美國FDA和歐盟EC的孤兒藥資格認定,並在美國啟動了一項H藥對比一線標準治療阿替利珠單抗的頭對頭橋接試驗。
