2025年6月2日,復宏漢霖(2696.HK)宣佈,公司創新型抗HER2單抗HLX22的最新研究結果在2025年美國臨床腫瘤學會(ASCO)年會上公佈,包括HLX22聯合曲妥珠單抗及化療一線治療HER2陽性晚期胃癌的II期臨床研究(HLX22-GC-201)的療效與安全性超兩年隨訪更新數據,以及頭對頭對比一線標準療法(曲妥珠單抗+化療±帕博利珠單抗)的國際多中心III期臨床研究(HLX22-GC-301)的研究設計首次發佈。HLX22-GC-201研究更新數據顯示,經過長期隨訪,HLX22在HER2陽性胃癌治療中依然展現出穩定的療效獲益,遠超歷史數據。HLX22-GC-301研究正在全球範圍內高效推進並已在多地完成首例患者給藥。目前,全球尚無同類用於治療HER2陽性胃癌的HER2雙靶向療法獲批准上市。

雙靶向雙表位結合HER2,突破胃癌一線治療桎梏
據GLOBOCAN數據顯示,2022年全球約有100萬胃癌新發病例,逾66萬死亡病例,疾病負擔呈現顯着地域不平衡[1],構成了一大健康問題。多數胃癌患者早期症狀隱匿,確診時已處於疾病晚期,總體預後不良,5年生存率僅為6%[2,3]。儘管近年來靶向治療(如抗HER2藥物)和免疫檢查點抑制劑(如抗PD-1/PD-L1單抗)在胃癌的治療中取得了一定進展[4],但鑑於該疾病具有高度分子異質性,不同亞型患者對化療、靶向治療和免疫治療的反應差異顯著[5]。免疫治療局限於PD-L1陽性人群,且療效改善有限。胃癌尤其是HER2陽性胃癌的整體治療仍存在巨大的未滿足的臨床需求。
HLX22是一款靶向HER2的創新型單克隆抗體,已於2025年獲得美國食品藥品監督管理局(FDA)和歐盟委員會(EC)授予的孤兒藥資格認定(Orphan Drug Designation, ODD),用於胃癌的治療。HLX22可結合在HER2的胞外亞結構域IV,但結合表位與曲妥珠單抗有所不同,使得該產品能夠與曲妥珠單抗同時結合至HER2,有效促進HER2二聚體(HER2同源二聚體及HER2/EGFR異源二聚體)的內吞和降解,將HER2的內吞效率提高了40%-80%,進而產生更強的HER2受體阻斷效果。臨床前研究表明,HLX22與曲妥珠單抗聯合治療能夠協同抑制腫瘤細胞增殖和誘導細胞凋亡,在體內和體外均表現出增強的抗腫瘤活性。
II期研究數據亮點:超2年隨訪,明顯延長PFS和OS
HLX22聯合漢曲優®(曲妥珠單抗,美國商品名:HERCESSI™️,歐洲商品名:Zercepac®)治療HER2陽性胃癌的II期臨床研究(HLX22-GC-201)結果顯示,在漢曲優®聯用化療的基礎上加入HLX22可提高HER2陽性G/GEJ癌患者一線治療的生存期和抗腫瘤反應,且安全性可控,有望重塑晚期胃癌的一線標準治療。該研究結果數據首次發佈於2024年美國臨床腫瘤學會胃腸道腫瘤研討會(ASCO GI),其後該研究數據及數據更新亦分別獲選發佈於Med和2024年歐洲腫瘤學會胃腸道腫瘤研討會(ESMO GI)、2025年美國臨床腫瘤學會胃腸道腫瘤研討會(ASCO GI)[6-9],多次驗證了研究結果可靠性的同時,更進一步提升了該研究在學術界的影響力。
HLX22-GC-201研究納入未經系統治療的局部晚期或轉移性HER2陽性胃/胃食管結合部癌(G/GEJC)患者,按1:1隨機分配至HLX22+曲妥珠單抗+XELOX組或安慰劑+曲妥珠單抗+XELOX組,每3周為一個治療周期。主要終點為獨立影像評估委員會(IRRC)根據實體瘤評價標準(RECIST v1.1)評估的無進展生存期(PFS)和客觀緩解率(ORR);次要終點包括其他療效及安全性指標。
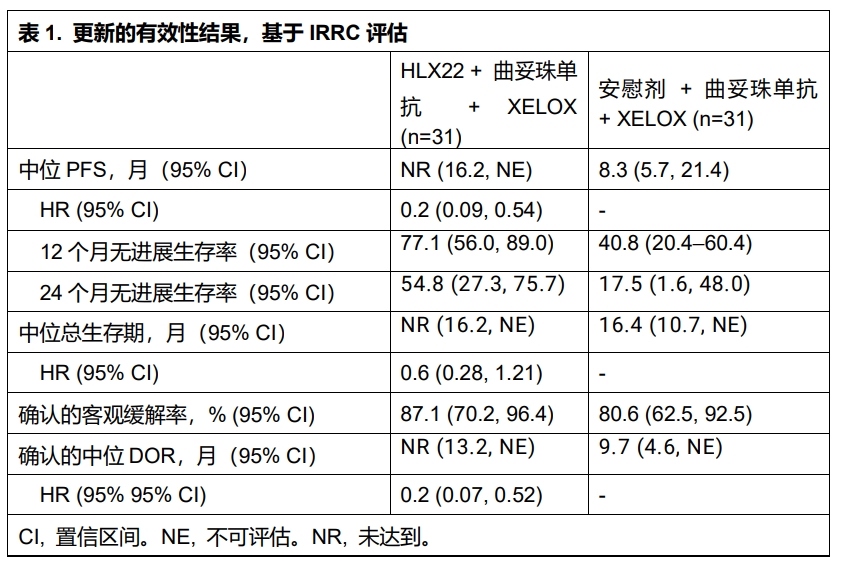
截至2024年12月6日,共有62名患者被隨機分組(31 vs 31),其中51名(82.3%)為男性。兩組中位隨訪周期分別為28.5個月和28.7個月。主要有效性結果參見表1。兩組分別有30例(96.8%)和31例(100%)患者報告了治療期間不良事件(TEAEs)。17例(54.8%)和15例(48.4%)患者中發生了3級或以上的TEAEs。安慰劑+曲妥珠單抗+XELOX組中,1例(3.2%)患者發生了HLX22或安慰劑相關的導致死亡的治療期不良事件(TEAE)。兩組各有1例患者(3.2%)報告與HLX22/安慰劑相關的導致治療終止的TEAE。HLX22-GC-201研究更新結果再次應證了HLX22聯合曲妥珠單抗及化療為HER2陽性G/GEJC患者帶來明顯的臨床獲益,且安全性可控。
III期頭對頭研究設計:國際多中心試驗全球加速推進
基於前瞻性HLX22-GC-201研究,公司進一步在更多人群中評價HLX22聯合曲妥珠單抗及化療一線治療HER2陽性晚期胃癌的療效與安全性,並開展一項頭對頭國際多中心III期臨床研究(HLX22-GC-301)。HLX22-GC-301由北京大學腫瘤醫院沈琳和MD安德森癌症中心教授、NCCN胃癌與食管癌專委會主席Jaffer A. Ajani教授共同擔任牽頭主要研究者。此次ASCO大會首次公佈HLX22-GC-301的試驗設計,該研究是一項隨機、雙盲、雙臂、國際多中心III期臨床試驗,旨在比較HLX22聯合曲妥珠單抗及XELOX方案與曲妥珠單抗及XELOX聯合或不聯合帕博利珠單抗一線治療HER2陽性晚期胃/胃食管結合部(G/GEJ)癌的療效與安全性。
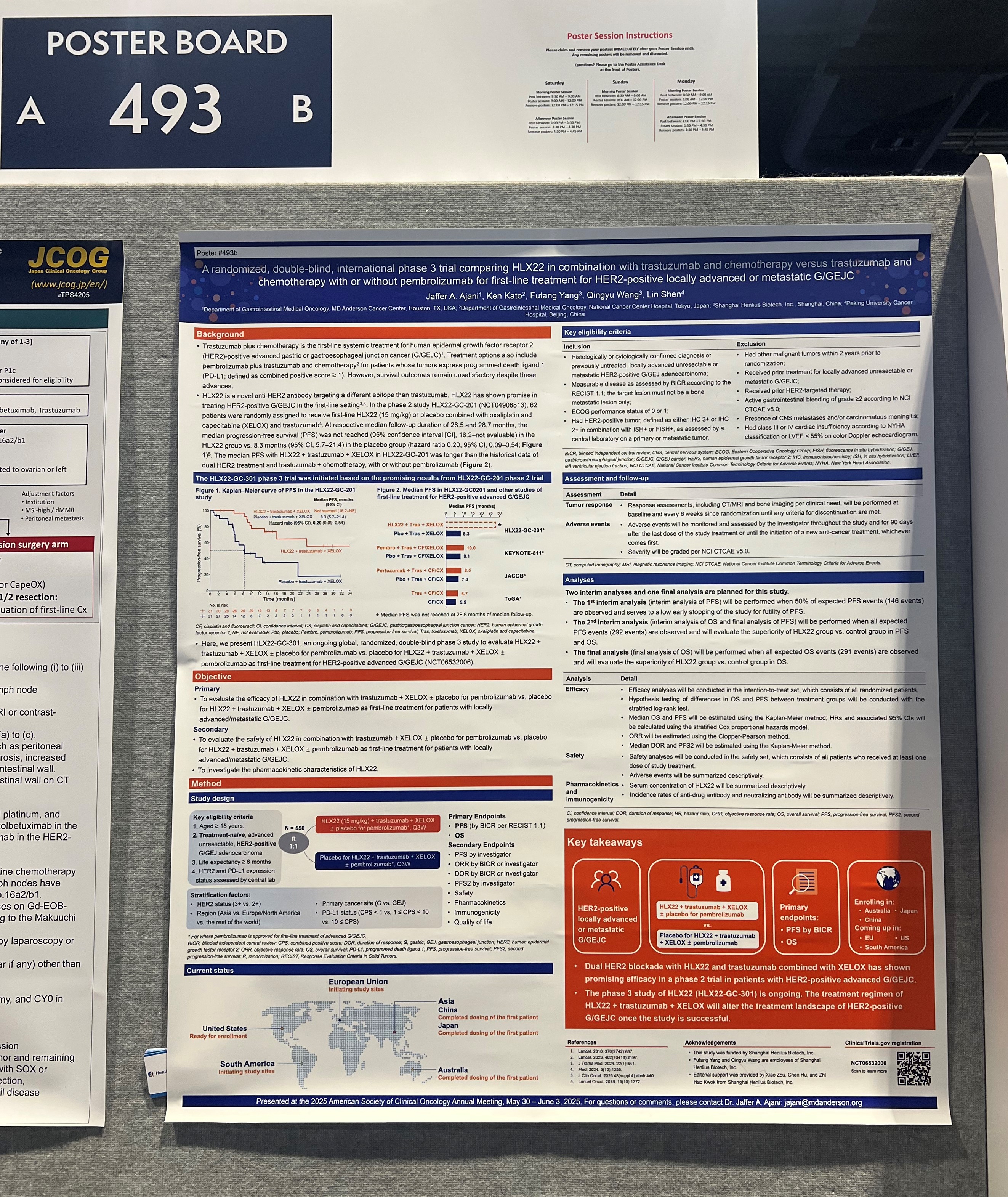
HLX22-GC-301關鍵入選標準包括經組織學或細胞學確診、既往未接受治療的局部晚期不可切除或轉移性、HER2陽性G/GEJ腺癌;關鍵排除標準包括既往接受過任何HER2靶向治療。研究計劃從全球多個地區入組約550例患者,按1:1隨機分配接受以下治療:HLX22(15 mg/kg)聯合曲妥珠單抗及XELOX±帕博利珠單抗安慰劑,或HLX22安慰劑聯合曲妥珠單抗及XELOX±帕博利珠單抗。HLX22的給藥在每個21天的治療周期的第1天通過靜脈輸注進行,持續給藥至喪失臨床獲益、死亡、出現不可耐受毒性、撤回知情同意或其他原因終止。分層因素包括HER2免疫組化評分(3+相比2+)、地理區域(亞洲相比歐洲/北美相比其他地區)、腫瘤原發部位(胃相比胃食管結合部)及腫瘤PD-L1表達(CPS <1或不可評估相比1≤CPS<10相比CPS≥10)。共同主要終點為獨立影像評估委員會基於實體瘤療效評價標準(RECIST v1.1)評估的無進展生存期(PFS),以及總生存期(OS);次要終點包括研究者評估的PFS、客觀緩解率、後續治療線的PFS、緩解持續時間、安全性、藥代動力學、免疫原性及生活質量。
值得一提的是,HLX22-GC-301同步於中國、澳大利亞、歐盟、日本、美國、南美洲等國家和地區開設試驗中心。截至目前,該研究已於中國、日本、澳大利亞完成首例受試者給藥,並已在美國、智利、韓國等國家和地區獲得臨床試驗開展許可。
繼HER2陽性胃癌之後,HLX22的治療領域已逐步拓寬至乳腺癌疾病領域。2025年4月,HLX22單抗聯合德曲妥珠單抗治療HER2低表達HR陽性的局部晚期或轉移性乳腺癌的II期臨床研究(HLX22-BC201)於中國境內完成首例患者給藥。HLX22聯合德曲妥珠單抗的臨床前動物試驗顯示,該抗HER2聯合療法展現出協同抗腫瘤作用和良好的安全性,有望為HER2表達腫瘤患者帶來更多獲益。未來,復宏漢霖也將持續探索新型抗HER2靶向療法在腫瘤中的治療潛力,高效推進HLX22的全球臨床開發進展,為全球患者提供更多可負擔、療效更好的治療方案。
參考文獻
[1] Bray F, Laversanne M, Sung H, et al. CA Cancer J Clin. 2024: 1-35.
[2] Ajani JA. et al. J Natl Compr Canc Netw 2022;20(2):167-92.
[3] Alsina M. et al. Nat Rev Gastroenterol Hepatol 2023;20(3):155-70.
[4] Miao, ZF.,et al. Progress and remaining challenges in comprehensive gastric cancer treatment. Holist Integ Oncol 1, 4 (2022).
[5] Guan, WL.,et al. Gastric cancer treatment: recent progress and future perspectives. J Hematol Oncol 16, 57 (2023).
[6] Jin Li et al., HLX22 plus HLX02 and XELOX for first-line treatment of HER2-positive locally advanced or metastatic gastric/gastroesophageal junction cancer: A randomized, double-blind, multicenter phase 2 study.. JCO 42, 354-354(2024).DOI:10.1200/JCO.2024.42.3_suppl.354
[7] J. Li et al., 422P HLX22 plus HLX02 and XELOX as first-line therapy for HER2-positive advanced gastric/gastroesophageal junction cancer: Updated results from a randomized, double-blind phase II study, Annals of Oncology,Annals of Oncology (2024) 35 (suppl_1): S162-S204. 10.1016/annonc/annonc1482
[8] Li N, et al. A randomized phase 2 study of HLX22 plus trastuzumab biosimilar HLX02 and XELOX as first-line therapy for HER2-positive advanced gastric cancer. Med. 2024;5(10):1255-1265.e2.
[9] Jin Li et al. HLX22 plus trastuzumab and XELOX for first-line treatment of HER2-positive locally advanced or metastatic gastric/gastroesophageal junction cancer (G/GEJC): Updated results with additional patients.. JCO 43, 440-440(2025). DOI:10.1200/JCO.2025.43.4_suppl.440
