2025年6月10日,復宏漢霖(2696.HK)宣佈,公司基於與宜聯生物的合作開發的靶向程序性死亡-配體1(PD-L1)的新型抗體偶聯藥物(ADC)注射用HLX43在晚期非小細胞肺癌(NSCLC)患者中開展的國際多中心II期臨床研究(HLX43-NSCLC201)於中國完成首例受試者給藥。在剛剛召開的2025 美國臨床腫瘤學會(ASCO)年會上,HLX43的I期臨床數據首次發佈,顯示出令人鼓舞的初步療效和安全性,對鱗狀/非鱗狀NSCLC,有無EGFR突變、有無腦/肝轉移、PD-L1陽性/陰性的NSCLC患者都展現了優異的治療潛力。目前,全球尚無同類靶向PD-L1的ADC產品獲批上市,HLX43為全球首個進入臨床II期的PD-L1 ADC。

廣譜抗腫瘤ADC,劍指實體瘤全人群生存突破
近年來,以抗PD-(L)1抗體為代表的免疫檢查點抑制劑(ICI)促進了腫瘤免疫治療的高速發展,成為腫瘤患者各線治療的主要手段之一。然而,部分患者對該療法無響應,或者出現耐藥[1]。對於免疫治療耐藥或經免疫治療等標準治療失敗後的患者人群,尚缺少有效的後線治療方案。ADC作為當下腫瘤治療中療效最突出的新型療法,已在乳腺癌、肺癌、食管癌、胃癌等多項實體瘤中展現出令人振奮的治療潛力,成為重要的探索方向[2]。而PD-L1作為一個泛腫瘤靶點,在非小細胞肺癌、頭頸鱗癌、結直腸癌、三陰性乳腺癌、黑色素瘤等癌種中均有表達,部分瘤種陽性率(高表達+中低表達)超過50%,在肺癌上更高達70%,且在正常組織中表達有限,使其成為開發ADC藥物的潛力靶點,為腫瘤治療帶來新的途徑[3]。
據GLOBOCAN最新數據顯示,肺癌是全球發病率和死亡率最高的癌症,2022年全球約有超過248萬新發肺癌病例,占癌症新發病例的12.4%[4],其中非小細胞肺癌(NSCLC)是最常見的肺癌類型(約85%)。大部分肺癌患者確診時已處於疾病晚期階段[5],存在巨大的尚未滿足的臨床需求。根據病理類型,NSCLC又可分為鱗狀細胞癌(約30%)、肺腺癌(約50%)等,儘管針對EGFR等驅動基因突變(AGA)的靶向治療方案已經趨於成熟,但在全部NSCLC患者中,EGFR野生型佔比高達70%-85%,涵蓋幾乎所有的鱗癌患者和50-55%的肺腺癌患者[6]。當前療效優異的產品仍較少,特別在2L+人等後線人群治療上,仍主要依賴於多西他賽為基礎的化療方案,後線治療的效果有限[7,8]。
NSCLC療效顯著,全球首款進入II期臨床的PD-L1 ADC
HLX43是一款靶向程序性死亡-配體1(PD-L1)的新型ADC候選藥物,由全人源IgG1抗PD-L1抗體與創新連接子-拓撲異構酶抑制劑荷載偶聯而成,藥物抗體比(drug-to-antibody ratio, DAR)約為8。HLX43兼具毒素精準殺傷和腫瘤免疫作用的複合功能:其毒素不僅能夠藉靶點內吞進入腫瘤細胞後進行釋放,並在腫瘤微環境中釋放後藉助旁觀者效應進入腫瘤細胞,阻斷DNA複製,從而導致腫瘤細胞凋亡;此外,HLX43的PD-L1靶向抗體可激活免疫調節機制,發揮協同抗腫瘤效應。臨床前及I期臨床研究顯示,HLX43具有顯著的抗腫瘤療效,且安全性良好。2.0 mg/kg每三周輸注一次HLX43時,晚期NSCLC患者經研究者評估的ORR為38.1%,對於四線及更後線治療的難治NSCLC患者,ORR仍可達38.5%。 其中鱗狀非小細胞肺癌sqNSCLC(n=15)和非鱗狀非小細胞肺癌nsqNSCLC(n=6)患者的客觀緩解率(ORR)分別為40%和33.3%,並實現了73.3%和100%的疾病控制。值得關注的是,腦轉移NSCLC患者全部得到疾病控制(DCR=100%)。相關臨床前及I期臨床研究數據分別於2023歐洲腫瘤內科學會(ESMO)大會和2025 美國臨床腫瘤學會 (ASCO)年會上發佈。
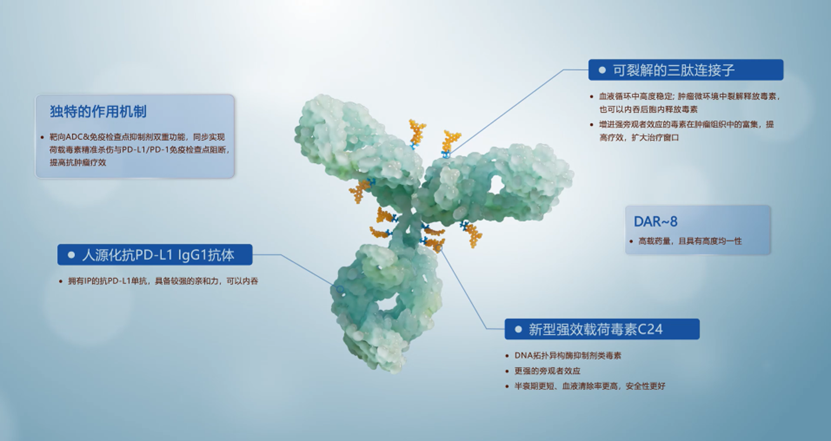
作為全球率先進入臨床階段的靶向PD-L1的ADC產品,HLX43於2023年相繼獲得中國藥品監督管理局(NMPA)、美國食品藥品監督管理局(FDA)的臨床試驗許可,目前已進入II期臨床開發階段,廣泛覆蓋非小細胞肺癌、胸腺鱗癌、肝細胞癌、食管鱗癌、頭頸鱗癌、宮頸癌、鼻咽癌等實體瘤的治療。單藥之外,HLX43聯用復宏漢霖自研斯魯利單抗(H藥漢斯狀®,抗PD-1單抗)治療實體瘤的 Ib/II 期臨床試驗也正在進行中,進一步探索「ADC+IO」的協同抗腫瘤療效。HLX43不僅可能克服PD-1/L1免疫療法不響應或耐藥問題,並對化療、TKI治療失敗的患者都具有潛在療效,有望為更多晚期/轉移性實體瘤患者帶來新的治療選擇。
未來,復宏漢霖將持續立足於未滿足的臨床需求,充分發揮公司在抗體藥物和抗體偶聯藥物領域的一體化平台優勢,加速推動更多前沿治療方案的研究和開發,為全球患者帶來更多高質量、可負擔的創新治療方案。
HLX43-NSCLC201
本研究為一項評估HLX43在晚期非小細胞肺癌(NSCLC)患者的開放、國際多中心II期臨床試驗,旨在評估HLX43在晚期NSCLC患者中的有效性和安全性。研究分為兩個階段:第一階段將進行劑量探索,以選擇合適的HLX43劑量進行第二階段研究。第二階段為單臂、多中心II期臨床研究。本研究的主要研究目的為評估HLX43在晚期非小細胞肺癌(NSCLC)中的臨床療效,次要研究目的為安全性、耐受性、藥代動力學特徵、免疫原性,以及探索潛在預測性或耐藥性生物標誌物。主要研究終點為由盲態獨立中心審查委員會根據RECIST v1.1標準評估的客觀緩解率。
