- 不依賴生物標誌物篩選:HLX43在各NSCLC亞組(有無EGFR突變、有無腦轉移、PD-L1陽性/陰性)中都展現了優異的抗腫瘤療效,其在晚期腦轉移NSCLC患者中cORR達36.4%,DCR為100%
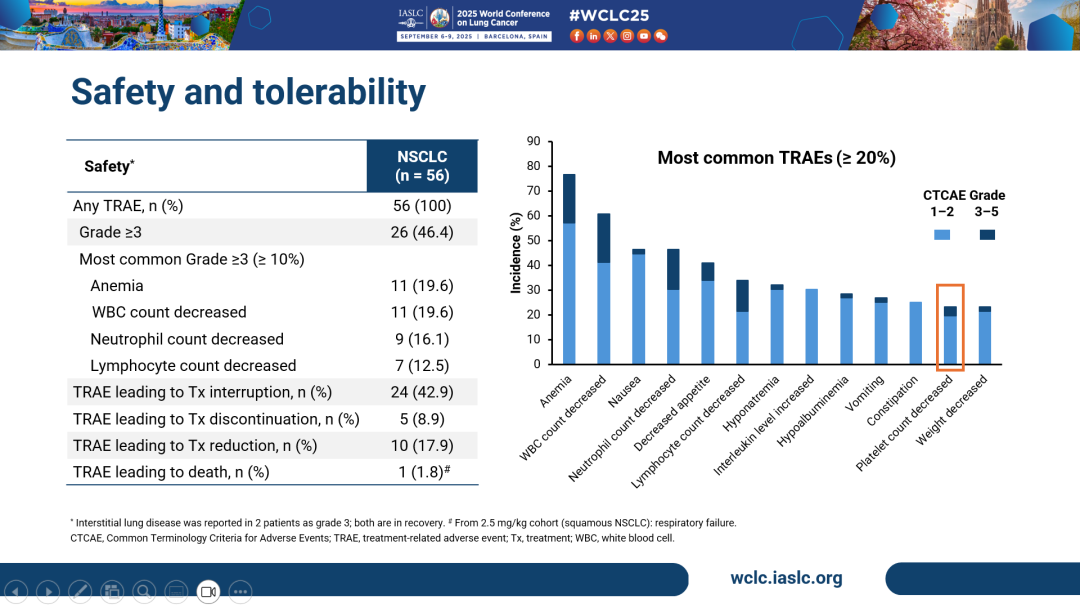
-「高效低毒」,安全性良好:HLX43相關的≥3級血液毒性發生率低,提示其擴展至1L治療及聯合治療的潛力:常見≥3級TRAE包括貧血(19.6%)、白細胞計數降低(19.6%)等,其中血小板計數降低僅3.6%。此外,免疫相關不良事件(irAE)提示HLX43可通過免疫激活機制強化抗腫瘤療效

此次更新的數據進一步驗證了HLX43在晚期非小細胞肺癌(NSCLC)等實體瘤中的卓越療效,有望為標準治療(免疫/化療/靶向等)失敗的後線耐藥NSCLC患者帶來更優的治療方案,並作為一款廣譜抗腫瘤基石藥物,進一步拓展至腫瘤前線治療及聯合治療方案。此前在2025美國臨床腫瘤學會(ASCO)年會上,HLX43的I期臨床數據首次發佈。

NSCLC療效優勢持續驗證,EGFR野生型後線治療潛力凸顯
據GLOBOCAN最新數據顯示,肺癌是全球發病率和死亡率最高的癌症,2022年全球約有超過248萬新發肺癌病例,占癌症新發病例的12.4%[1],其中非小細胞肺癌(NSCLC)是最常見的肺癌類型(約85%)。大部分肺癌患者確診時已處於疾病晚期階段,5年相對生存率較低[2],存在巨大的尚未滿足的臨床需求。根據病理類型,NSCLC又可分為鱗狀細胞癌(約30%)、肺腺癌(約50%)等,在全部NSCLC患者中,EGFR野生型佔比高達70%-85%,涵蓋幾乎所有的鱗癌患者和高達50%的肺腺癌患者[3]。當前優異療效產品仍較少,特別在2L+人等後線人群治療上,仍然主要依賴於多西他賽為基礎的化療方案。因此,EGFR野生型NSCLC後線治療仍是臨床上亟待突破的難題之一[4,5]。
此次發佈的更新研究數據來自一項開放標籤、評估HLX43(抗 PD-L1 ADC)在晚期/轉移性實體瘤患者中的安全性、藥代動力學特徵和初步療效的首次人體 I 期臨床研究(本次更新NSCLC人群數據)。研究包括Ia(劑量遞增)的Ib期(劑量擴展)兩個階段。在Ia期中,組織學或細胞學確診為晚期/轉移性惡性實體瘤且對標準治療無效或無法接受標準治療的患者接受每三周一次(Q3W)0.5 mg/kg、1 mg/kg、2 mg/kg、2.5 mg/kg、3 mg/kg或4 mg/kg HLX43靜脈注射。在Ib期中,對標準治療無效的晚期/轉移性NSCLC患者給與2mg/kg、2.5 mg/kg或3 mg/kg HLX43 (Q3W) 靜脈注射,Ib期的主要終點為推薦的II期劑量(RP2D)和客觀緩解率(ORR)。

- 本次更新的NSCLC患者數據來自Ia期+Ib期2.0 mg/kg劑量組及2.5 mg/kg劑量組。中位隨訪時間為9.0個月。
- 截至數據截止日期2025年6月28日,共計56例NSCLC患者入組Ia期及Ib期2.0和2.5 mg/kg劑量組,其中29例(51.8%)為鱗狀,27例(48.2%)為非鱗狀。鱗狀NSCLC中,10例(34.5%)患者經多西他賽治療失敗。非鱗狀NSCLC中,EGFR野生型/突變患者分別為15例(55.6%)及12例(44.4%)。
- 其中,非鱗狀NSCLC患者為三線及以上後線人群(中位既往治療線數:2),鱗狀NSCLC患者為四線及以上後線人群(中位既往治療線數:3)。54例(96.4%)患者接受過鉑類藥物治療,50例(89.3%)患者和26例(46.4%)患者分別接受過免疫治療和靶向治療,14例患者(25%)接受過多西他賽治療。
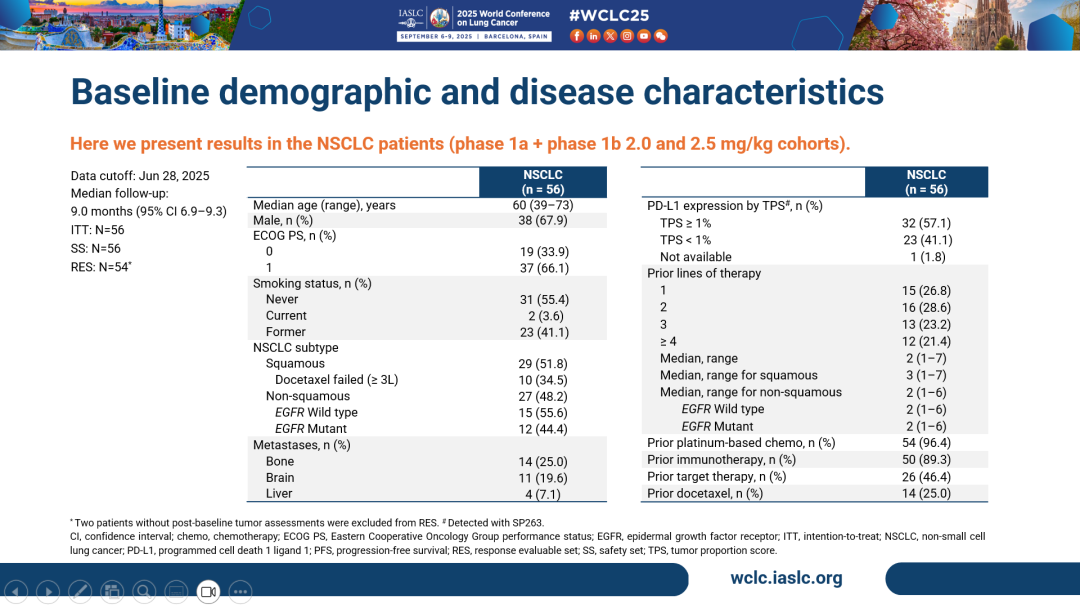
- 經研究者評估,54例可評估療效患者的ORR為37.0%,疾病控制率(DCR)為87.0%。
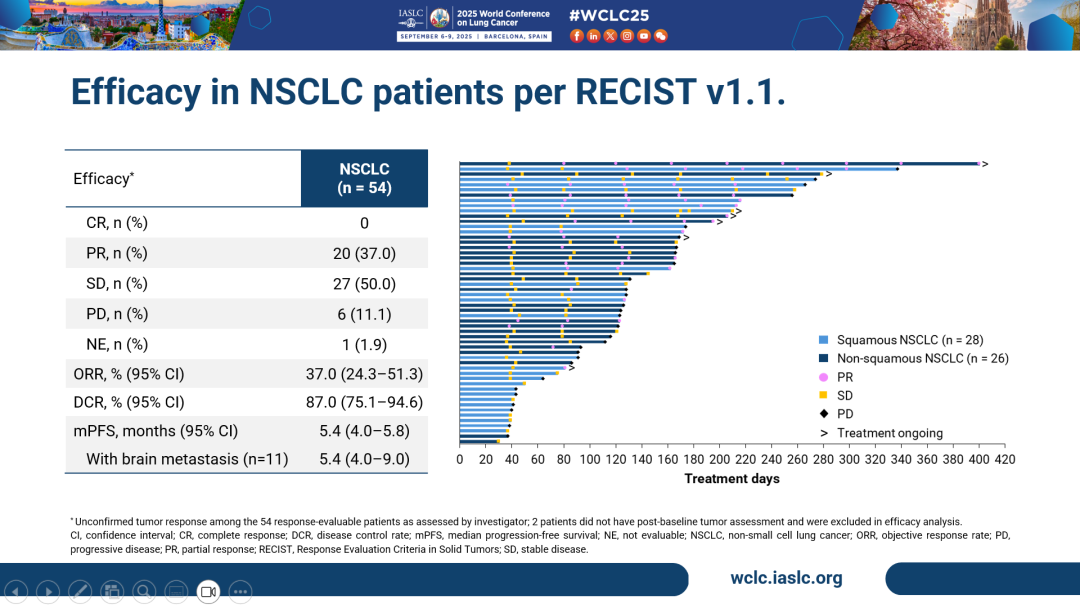
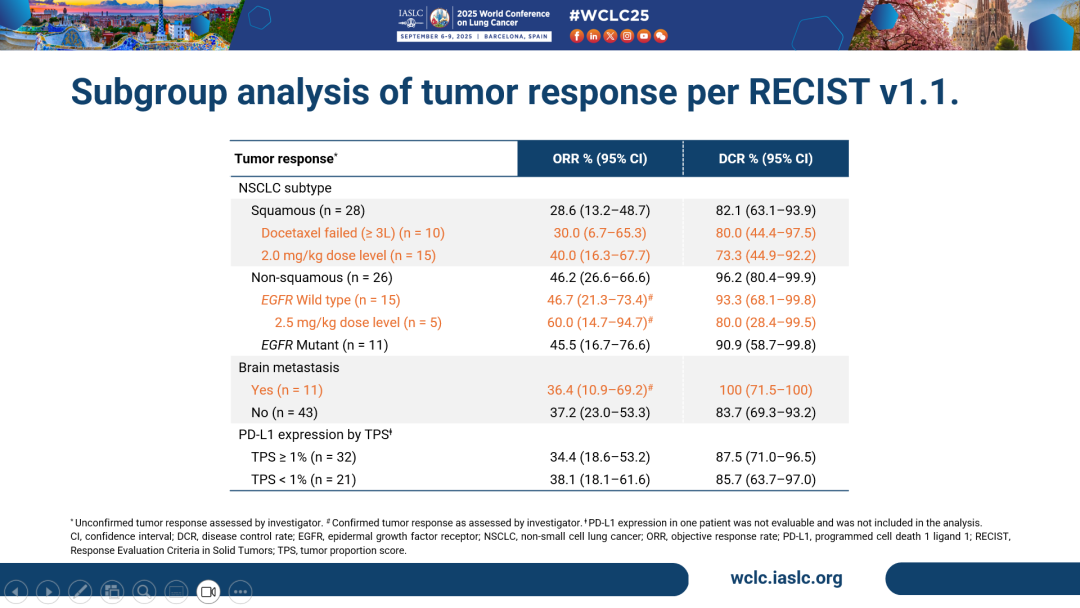
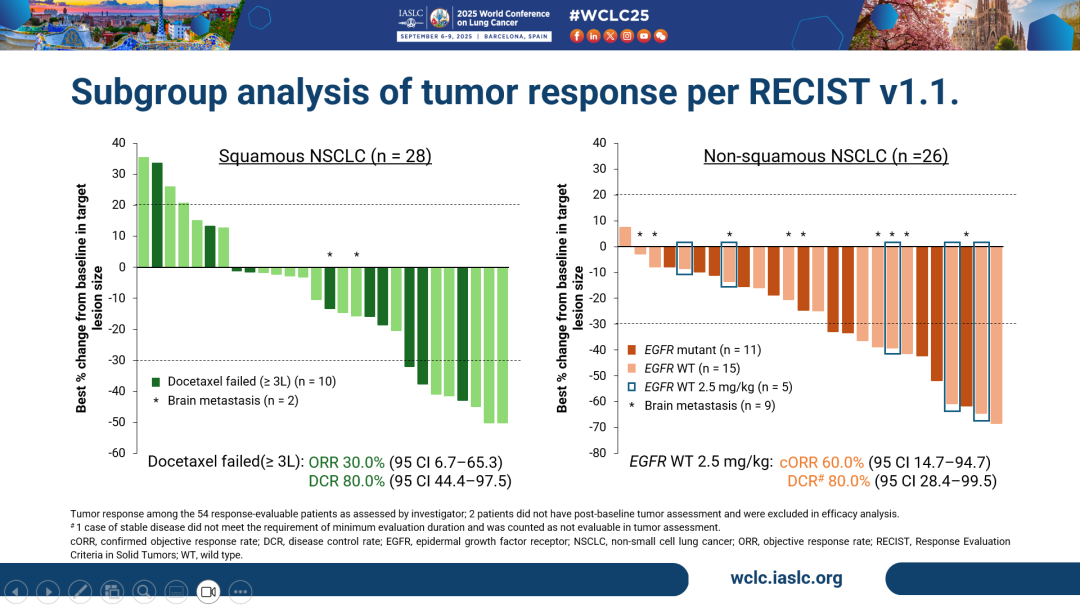
- 亞組分析結果顯示,在四線及以後的鱗狀NSCLC患者(n=28)中,HLX43的ORR為28.6%,DCR為82.1%,較標準治療藥物多西他賽(ORR=12.8%)展現出顯著的臨床獲益。值得關注的是,既往接受過多西他賽治療的三線及後線NSCLC患者(n=10)ORR達30.0%,DCR為80%;接受2 mg/kg劑量HLX43治療患者(n=15)ORR達40.0%,DCR為73.3%,提示HLX43在肺鱗癌後線治療中的重要潛力。
- 在三線及以後的非鱗狀NSCLC人群中(n=26),ORR達46.2%,DCR為96.2%。值得關注的是,EGFR野生型非鱗狀NSCLC患者(n=15)的經確認客觀緩解率(cORR)為46.7%,DCR達93.3%。接受2.5 mg/kg劑量HLX43治療的患者(n=5)cORR高達60.0%,DCR為80%,彰顯HLX43在非鱗狀NSCLC患者人群中更為顯著的療效優勢。
- 在晚期的腦轉移NSCLC患者(n=11)中,HLX43仍帶來了顯著的治療獲益,cORR為36.4%,DCR達100.0%。
- 在PD-L1陰性(TPS<1%,n=21)患者群體中,HLX43展現了差異化的治療潛力,ORR和DCR分別達到38.1%和85.7%,提示HLX43療效不受PD-L1表達限制,有望覆蓋更廣泛的患者群體。
- 安全性方面,最常見的≥3級治療相關不良事件(TRAEs)為貧血(19.6%)、白細胞計數減少(19.6%)、中性粒細胞計數減少(16.1%)及淋巴細胞計數減少(12.5%),血小板計數減少僅3.6%。與此前在2025 ASCO上披露的安全性一致,HLX43血液學毒性較低,延續了良好的安全性,支持未來擴展至一線療法及聯合治療方案。
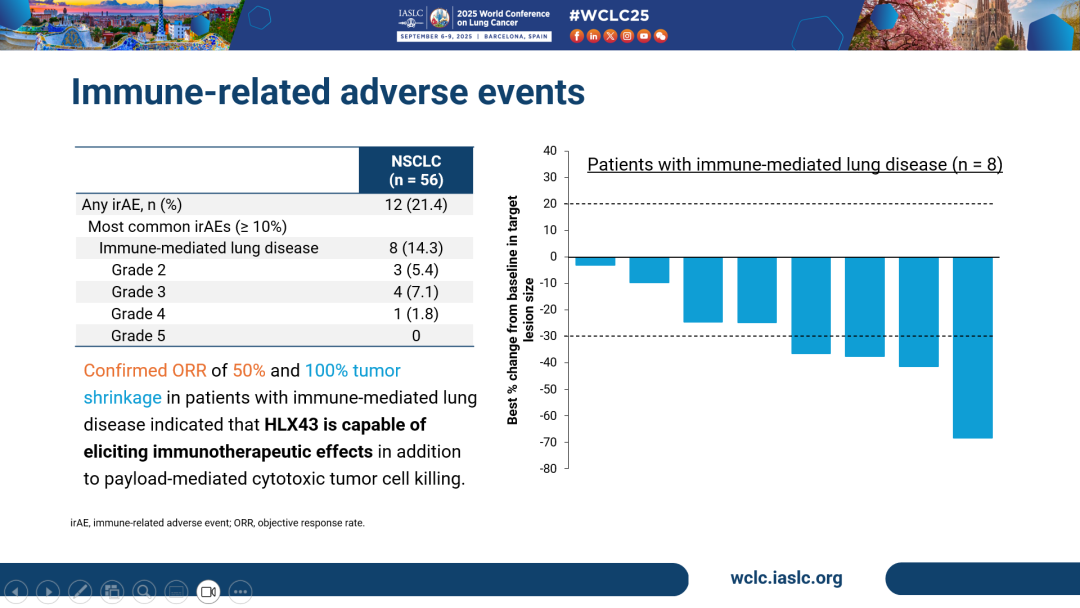
- 其中,12例(21.4%)患者報告了免疫相關不良事件(irAE),8例(14.3%)患者出現免疫相關性肺病,多數為1-3級。
- 同時,在發生免疫相關性肺病的患者人群中觀察到更高的治療獲益,包括50.0%的cORR 及100%的腫瘤縮小率,提示HLX43可能「雙管齊下」,其療效經由小分子毒素以及免疫機制介導。
潛在同類最優PD-L1 ADC,中美日澳全球開發進程全速推進
HLX43是一款潛在BIC的廣譜抗腫瘤ADC,兼具免疫檢查點阻斷與載荷細胞毒性的雙重作用機制。臨床前研究顯示,HLX43在PD-1/PD-L1單抗耐藥的非小細胞肺癌、宮頸癌、食管鱗癌等多個瘤種中顯示出顯著療效,且耐受性良好。HLX43的I期臨床數據顯示其在NSCLC、胸腺鱗癌(TSCC)等實體瘤中展現出「高效、低毒」的治療潛力,且對於鱗狀/非鱗狀NSCLC,有無EGFR突變、有無腦/肝轉移、PD-L1陽性/陰性的NSCLC患者人群都顯示出優異療效,不依賴生物標誌物篩選。
目前,公司正全力推進HLX43的臨床開發進程,已在全球入組超過300例患者,並在中國、美國、日本等多國順利推進患者入組。尤其在NSCLC適應症上,該國際多中心II期臨床研究已累計獲得中、美、日、澳等國家藥監機構的臨床許可,並在中、美兩國完成首例受試者給藥。同時,HLX43作為全球首個佈局胸腺癌(TC)的PD-L1 ADC,已在美國等地獲得該適應症的臨床試驗許可,計劃於近期啟動國際多中心臨床研究,加速填補這一罕見高侵襲癌種ADC治療的空白。
此外,復宏漢霖積極探索HLX43在多種實體瘤中的治療潛力,包括宮頸癌、肝細胞癌、食管鱗癌、頭頸鱗癌、鼻咽癌、結直腸癌、胃癌/胃食管交界部癌等,持續挖掘治療潛力。單藥之外,HLX43聯用其他產品的臨床試驗也正在進行中,進一步探索「ADC+IO」的協同抗腫瘤療效。HLX43不僅可能克服PD-1/L1免疫療法不響應或耐藥問題,並對化療、靶向治療失敗的患者都具有潛在療效,有望為更多晚期/轉移性實體瘤患者帶來新的治療選擇。
【參考文獻】
[1] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-263.
[2] Robinson CG, et al. Postoperative Radiotherapy for Pathologic N2 Non–Small-Cell Lung Cancer Treated with Adjuvant Chemotherapy: A Review of the National Cancer Data Base. Journal of Clinical Oncology 2015, 33(8): 870-876.
[3] Stanzione, B.; et al. Non-Small Cell Lung Cancer with Epidermal Growth Factor Receptor (EGFR) Common Mutations: New Strategies. Cancers 2025, 17, 1515.
[4]中國臨床腫瘤學會中國臨床腫瘤學會(CSCO).(2024)非小細胞肺癌診療指南
[5] NCCN Guidelines Version 3. 2025, Non-Small Cell Lung Cancer.
