2025年11月2日,復宏漢霖(2696.HK)於上海召開的「2025國際肺癌前沿及創新論壇」上,公佈了其PD-L1 ADC HLX43用於治療非小細胞肺癌(NSCLC)的關鍵更新數據。本次發佈首次合併了該產品國際多中心II期臨床研究的結果,重點展示了II/III期推薦劑量(RP2/3D)下的產品療效和安全性,持續驗證了HLX43在NSCLC等實體瘤中的突出療效及更廣泛人群中的臨床價值。

基於前期劑量探索結果,我們前瞻性確定了2.0 mg/kg 或 2.5 mg/kg 作為HLX43在NSCLC研究中的II/III期推薦劑量(RP2/3D)。此次發佈的更新NSCLC人群研究數據,即聚焦於呈現HLX43在NSCLC研究領域的關鍵數據。為此我們整合了自HLX43-FIH101及HLX43-NSCLC201兩項研究中,分別接受這兩個劑量治療的NSCLC患者數據(合計174例),以系統性評估RP2/3D下的療效和安全性,為後續關鍵臨床試驗的決策提供核心依據。
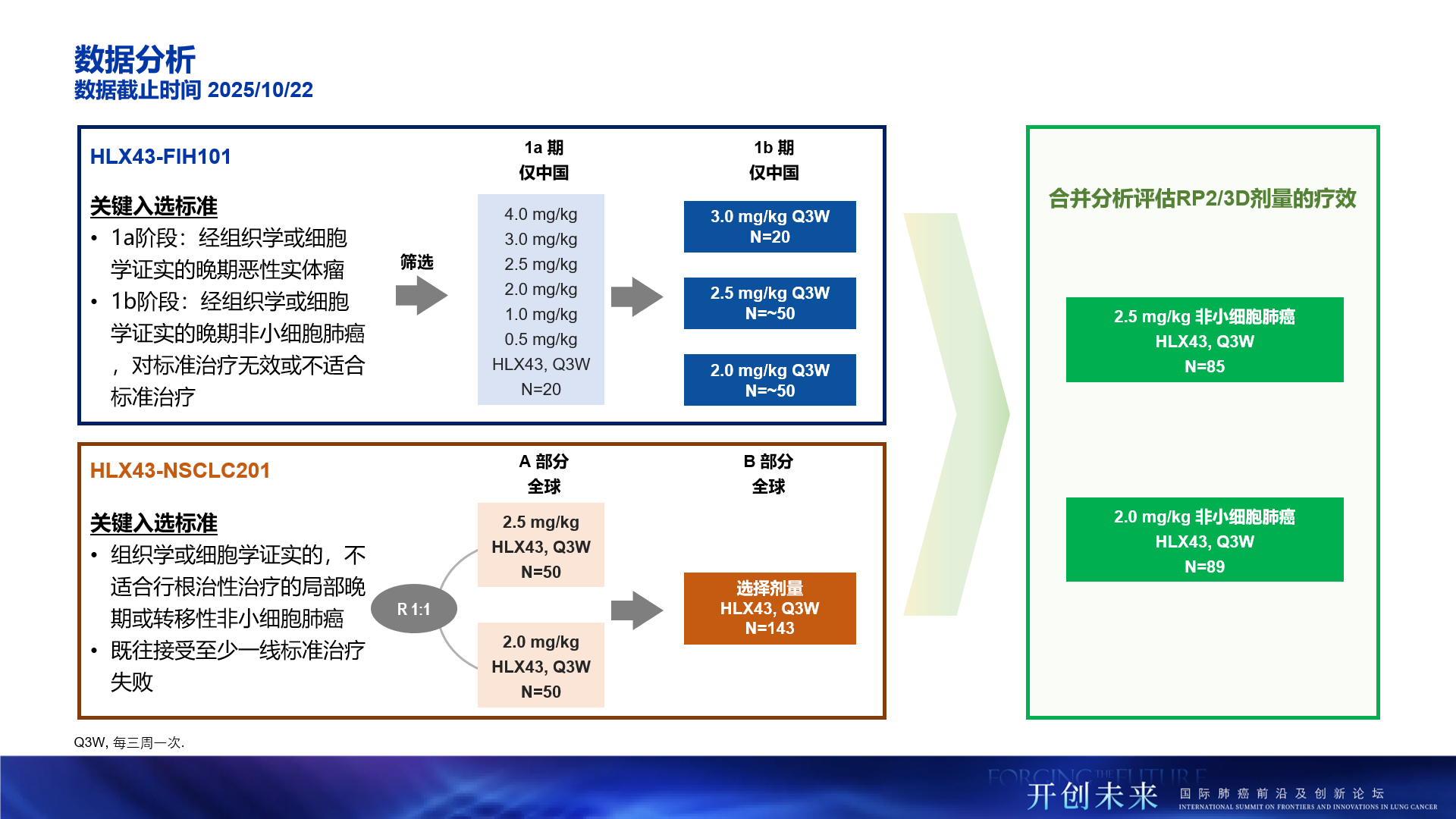
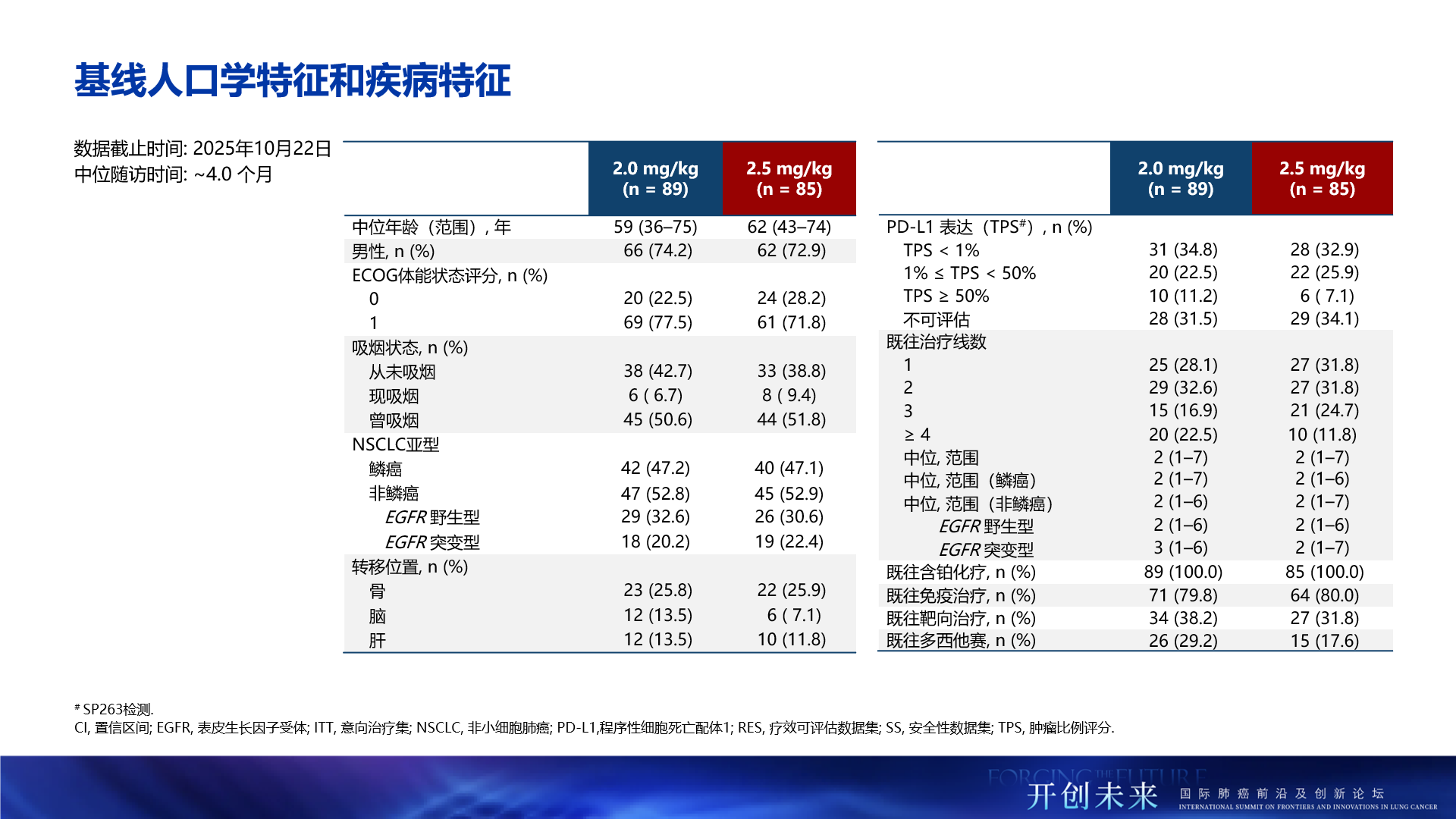
截至2025年10月22日,研究共納入174例晚期NSCLC患者,其中接受2.0 mg/kg HLX43靜脈注射治療的患者為89例,接受2.5 mg/kg 治療的患者為85例。全部患者(100%)接受過鉑類藥物治療,約80%和逾30%的患者分別接受過免疫治療和靶向治療,部分患者接受過多西他賽治療,均為後線經治人群。
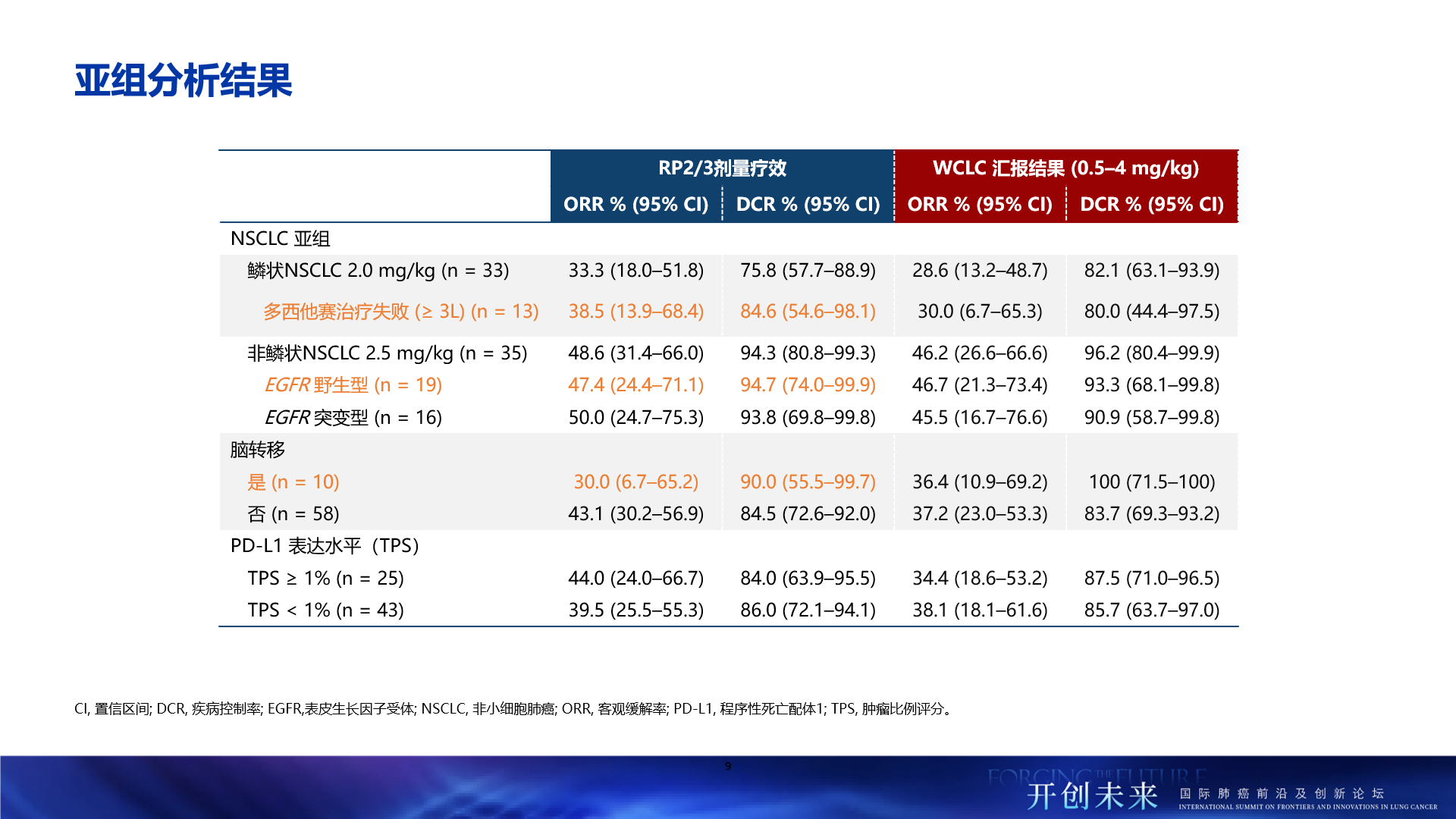
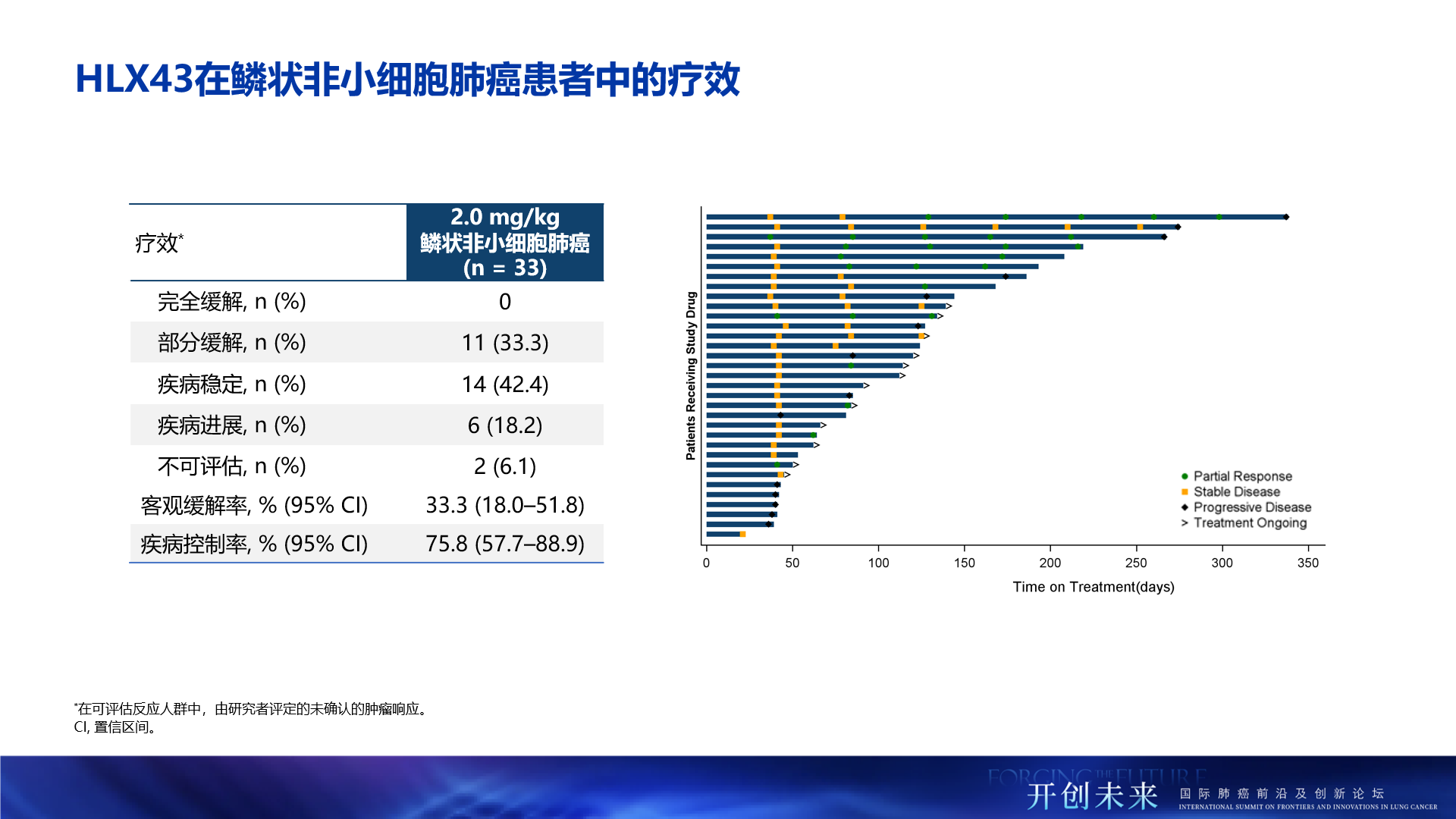
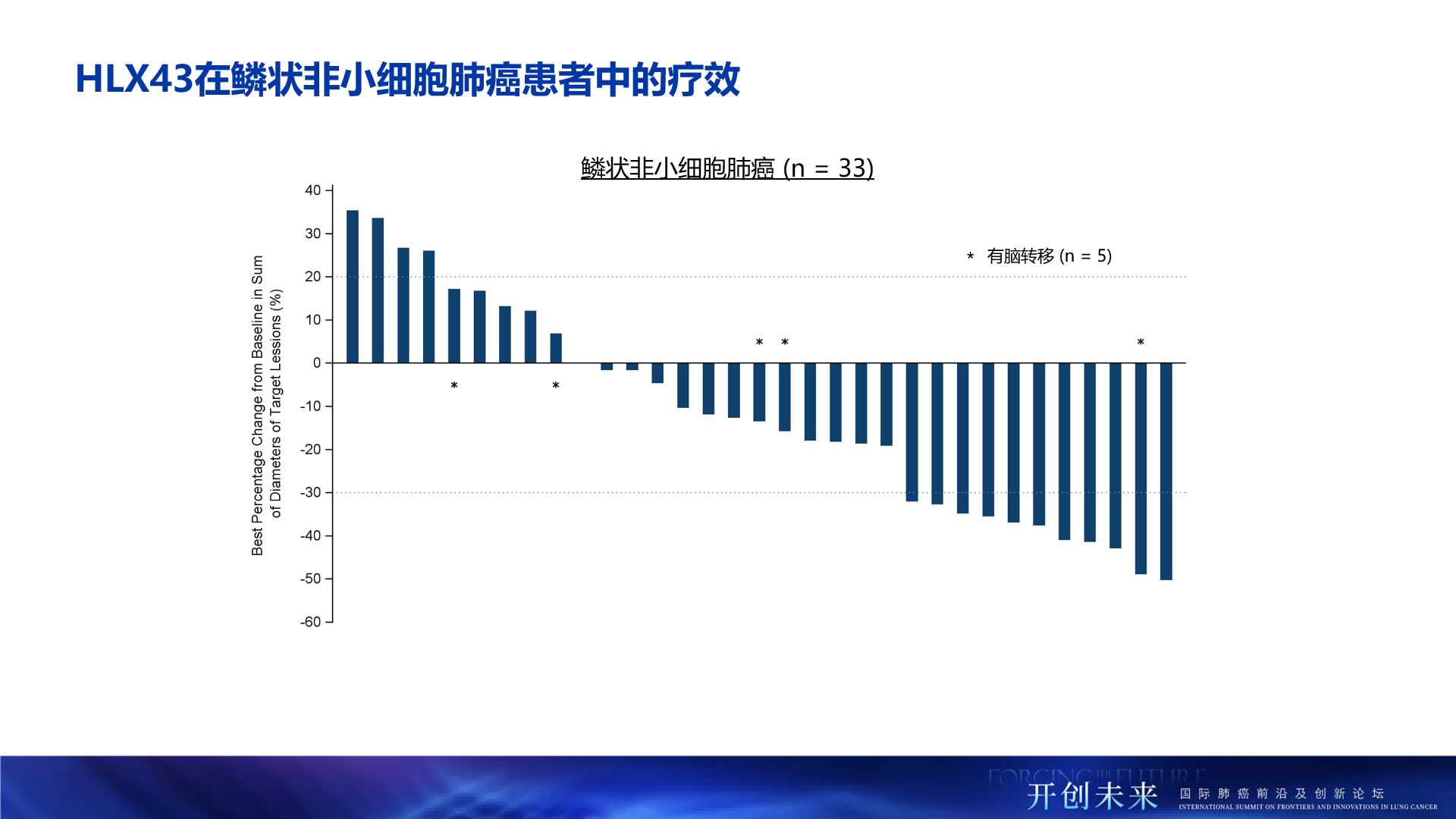
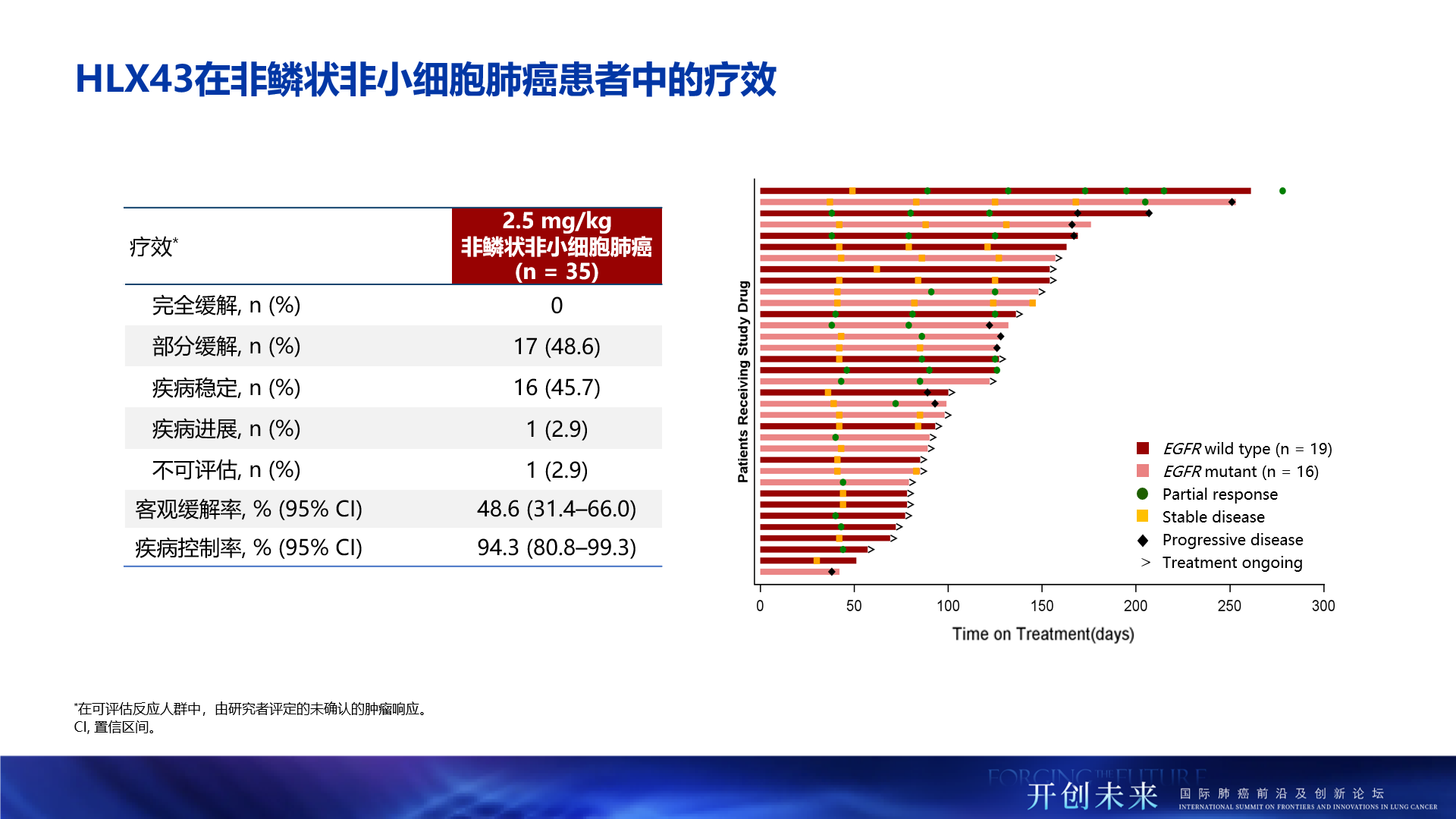
- 總人群療效顯著:經研究者評估,在鱗狀非小細胞肺癌患者(2mg/kg,n=33)中,HLX43的客觀緩解率(ORR)達33.3%,疾病控制率(DCR)為75.8%;在非鱗癌患者(2.5mg/kg,n=35,包括EGFR 野生型及EGFR突變)中,療效更為突出,ORR提升至48.6%,DCR高達94.3%
- 多西他賽失敗人群療效突出:曾接受過多西他賽治療的三線及後線鱗狀NSCLC患者(2mg/kg,n=13)中,ORR達38.5%,DCR為84.6%,提示HLX43在多西他賽治療失敗的肺鱗癌人群中的重要潛力
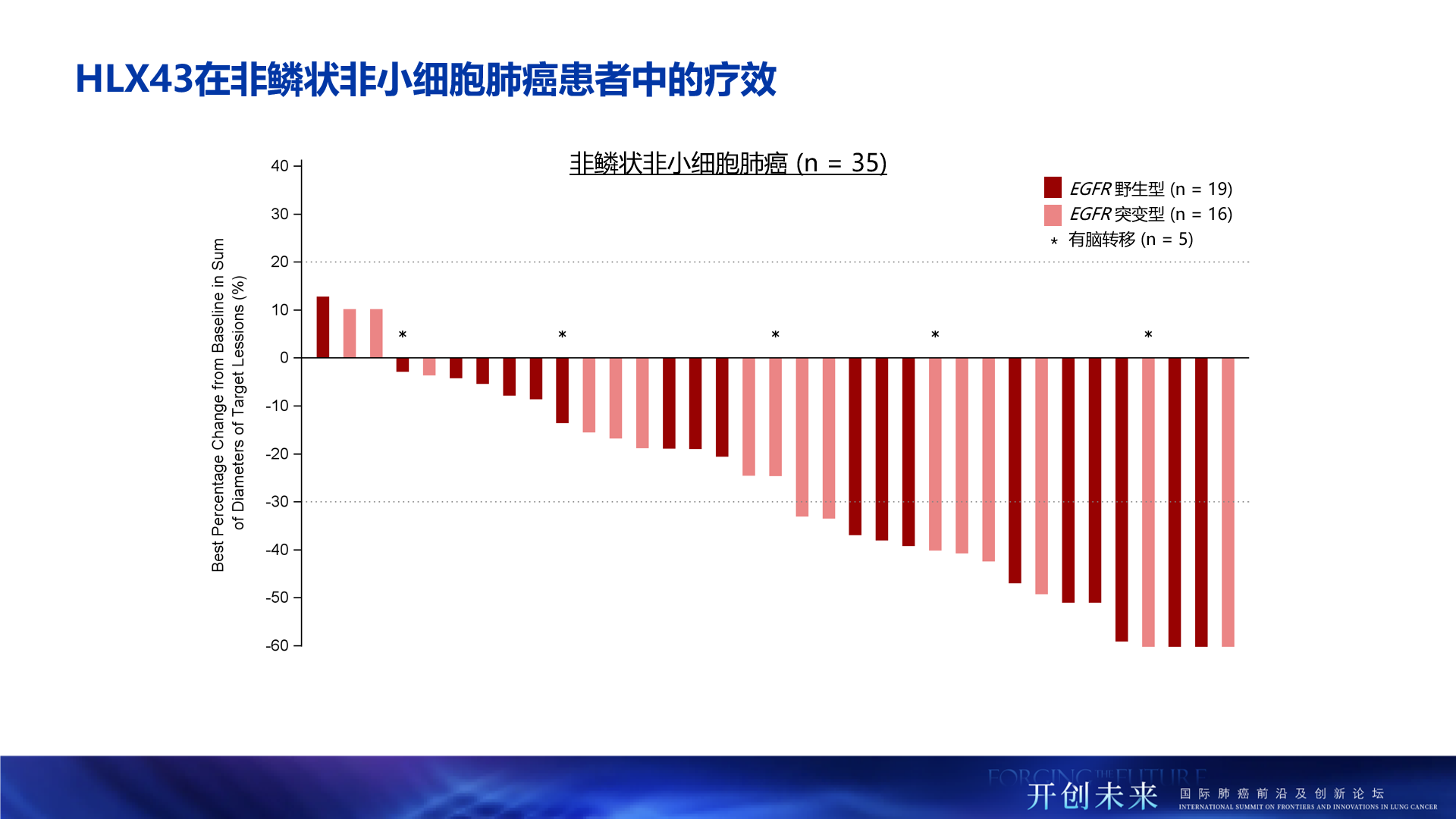
- 非鱗狀NSCLC治療優勢:在非鱗狀NSCLC患者中(2.5mg/kg,n=35),ORR達48.6%,DCR為94.3%。值得關注的是,EGFR野生型非鱗狀NSCLC患者(n=19)的ORR達47.4%,DCR達94.7%。EGFR突變的非鱗狀NSCLC患者(n=16)中,ORR達50.0%,DCR達93.8%。彰顯了HLX43在非鱗狀NSCLC患者人群中更為顯著的療效優勢
- 腦轉移患者有效:在晚期的腦轉移NSCLC患者(n=10)中,HLX43仍帶來了顯著的治療獲益,ORR為30.0%,DCR達90.0%
- 療效不受PD-L1表達限制:在PD-L1陰性(TPS<1%,n=43)患者群體中,HLX43展現了差異化的治療潛力,ORR和DCR分別達到39.5%和86.0%,提示HLX43療效不受PD-L1表達限制,有望覆蓋更廣泛的患者群體
安全性數據更新
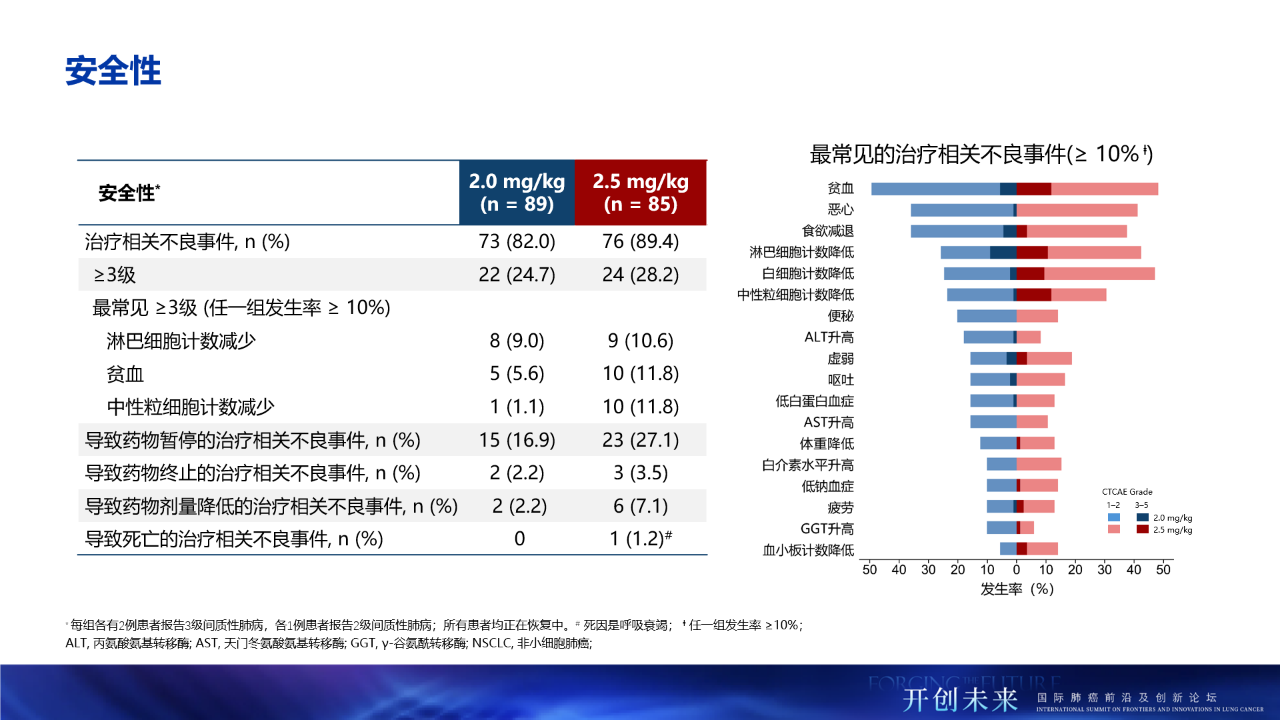
- 安全性方面,最常見的≥3級治療相關不良事件(TRAEs)包括淋巴細胞計數減少(9.8%)、貧血(8.6%)、中性粒細胞計數減少(6.3%),血小板計數減少僅1.7%。HLX43血液學毒性較低,延續了良好的安全性,支持未來擴展至一線療法及聯合治療方案
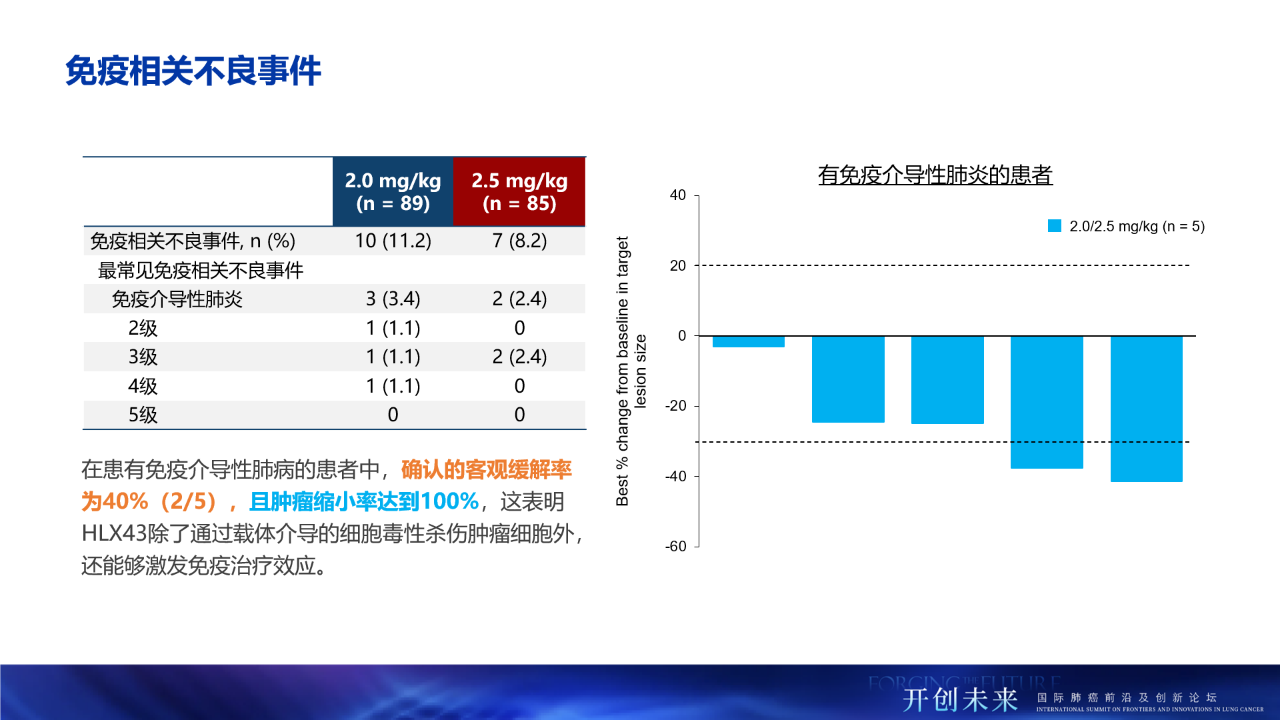
- 其中,17例(9.8%)患者報告了免疫相關不良事件(irAE),5例(2.9%)患者出現免疫相關性肺病,目前均在恢復中。
- 同時,在發生免疫相關性肺病的患者人群中觀察到顯著治療獲益,包括40.0%的經確認客觀緩解率(cORR)及100%的腫瘤縮小率,提示HLX43可能「雙管齊下」,其療效經由小分子毒素以及免疫機制介導。
雙優實力加速廣譜佈局,臨床價值持續釋放
HLX43優異的臨床療效和安全性特徵,源自其精準的分子設計和多重創新機制。不同於市面上眾多針對驅動基因突變的ADC,HLX43選擇了PD-L1這一泛瘤種靶點,不依賴生物標誌物的篩選,真正具備廣譜ADC的開發潛力。HLX43的抗體骨架採用復宏漢霖自主研發的HLX20,具有抗原的高結合能力及腫瘤細胞的內吞效率,連接子—毒素引進自具有技術優勢的宜聯TMALIN®平台,可裂解型連接子不僅通過內吞途徑胞內釋放毒素,還能夠在腫瘤微環境中激活釋放毒素,實現毒素於「胞內」和「胞外」的同時釋放,基於此,HLX43兼具了ADC靶向殺傷與PD-L1/PD-1免疫檢查點抑制劑(IO)的雙重作用機制,使其成為一款具備雙優潛力的ADC候選分子。
HLX43於2023年相繼獲得中國藥品監督管理局(NMPA)、美國食品藥品監督管理局(FDA)的臨床試驗許可。目前,公司正全力推進HLX43臨床開發進程,在全球入組超過400例患者,其中NSCLC患者超過170例,並在中國、美國、日本等多國順利推進患者入組。尤其在NSCLC適應症上,一項國際多中心II期臨床研究正在中、美、日、澳等國家同步開展。隨着這一適應症的後線療效逐步得到驗證,公司亦計劃開展一項HLX43頭對頭對比多西他賽的二線臨床研究;此外,基於HLX43展現出的低毒及IO功能,復宏漢霖將積極探索推進HLX43的一線治療方案,開展一項包括單藥、聯合其他免疫治療藥物以及對比現有標準治療的三臂試驗。同時,HLX43作為全球首個佈局胸腺癌的PD-L1 ADC,其國際多中心臨床研究在中、美、日、澳等國家同步推進。2025年10月,基於HLX43在胸腺癌後線治療中優異的初步療效,該產品獲得FDA孤兒藥資格認定,有望填補這一罕見高侵襲癌種 ADC治療的空白。
