2025年12月1日,復宏漢霖(2696.HK)宣佈,公司自研的HLX37(重組人源化抗PD-L1與VEGF雙特異性抗體)用於晚期/轉移性實體瘤治療的I期臨床研究獲中國國家藥品監督管理局(NMPA)批准。
PD-L1(Programmed Cell Death Ligand-1),又稱作 B7H1 和 CD274,是腫瘤免疫逃逸的關鍵分子,通過與 T 細胞表面的 PD-1 受體結合,抑制 T 細胞活化與增殖,從而削弱機體對腫瘤的免疫監視能力[1]。研究表明,PD-L1 在多種實體瘤中高表達,如非小細胞肺 癌、胃癌、卵巢癌等,且其表達水平與免疫治療療效相關[2,3]。PD-1/L1 抑制劑已在臨床中廣泛應用,但單藥治療響應率有限,部分患者因適應性耐藥或 T 細胞耗竭而復發[4]。VEGFA(vascular endothelial growth factor A)又稱作 VEGF,是腫瘤血管生成的核心調控因子,可促進異常血管生成,為腫瘤提供氧氣和營養支持,同時形成免疫抑制性微環境[5]。VEGF 是 VEGF 蛋白家族(包括VEGFA、VEGFB、VEGFC、VEGFD 和胎盤生長因子 PIGF)的一員,可與受體 VEGFR1和 VEGFR2 結合[6]。VEGF 驅動的腫瘤血管發育不全會導致缺氧和酸性微環境,促進 PD-L1 表達,同時招募免疫抑制細胞(如調節性 T 細胞),加劇 T 細胞耗竭,削弱抗 PD-1/L1 治療的療效。PD-L1介導的T 細胞抑制也能釋放促血管生成因子(如 IL-8、VEGF 自身),形成「免疫-血管生成」惡性循環[7]。因此,靶向PD-L1 和VEGF 能夠在治療腫瘤上發揮良好的協同作用。
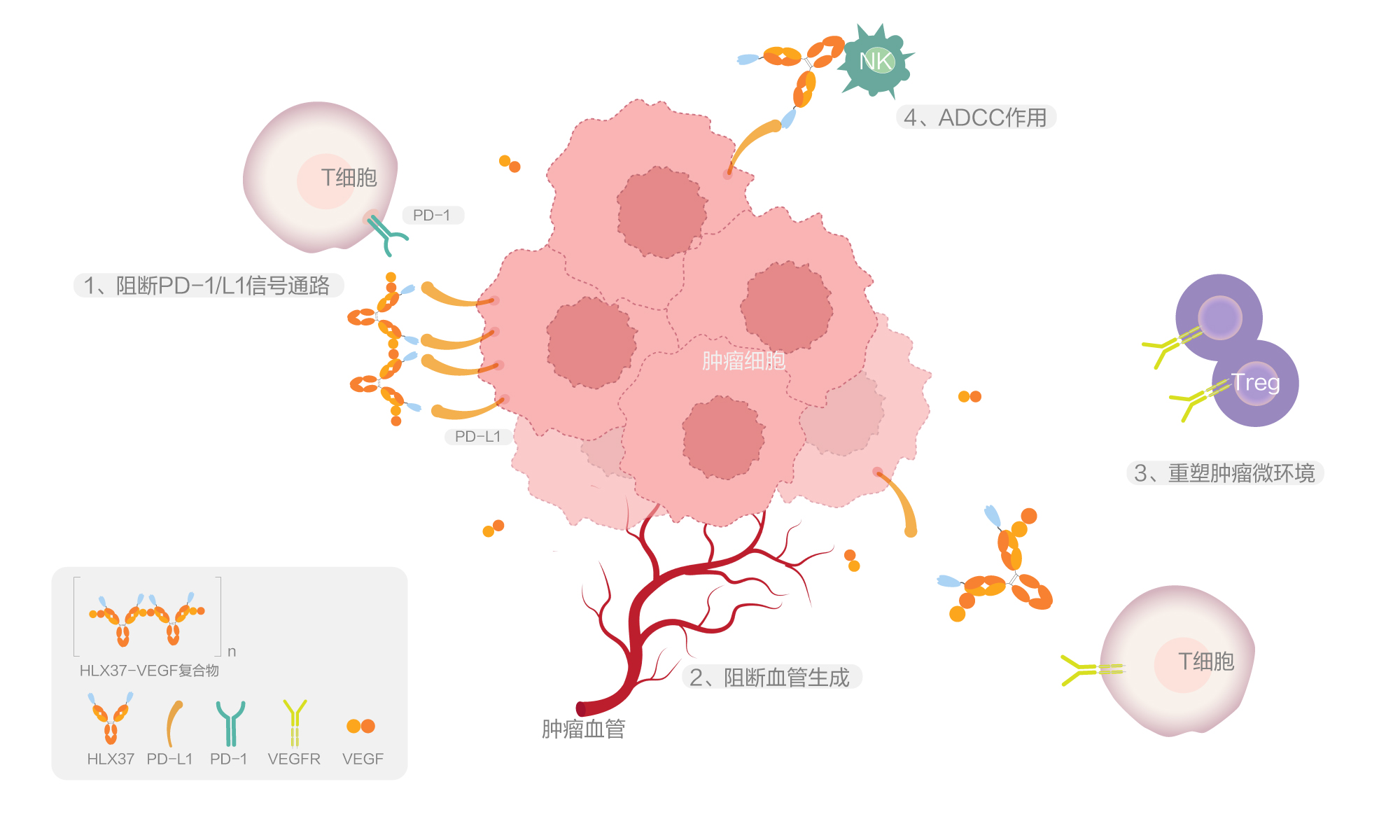
HLX37 是復宏漢霖自研的重組人源化抗PD-L1 與 VEGF 雙特異性抗體。其作用機制結合了兩種治療路徑:1)阻斷PD-1 /PD-L1結合:通過阻斷腫瘤細胞表面的PD-L1蛋白與免疫細胞(如T細胞)上的PD-1受體結合,解除腫瘤免疫抑制,恢復T 細胞對腫瘤的殺傷能力;2)阻斷血管生成通路:靶向VEGF,減少腫瘤血管生成,從而限制腫瘤的血液供應生長和轉移。這種雙靶點設計有望產生協同抗腫瘤效應,並可能降低耐藥性風險,通過特異性結合腫瘤細胞PD-L1實現腫瘤內部具有抗VEGF功能的HLX37 雙抗分子的富集,實現大於抗PD-L1 單抗和抗VEGF 單抗的聯合療效。臨床前研究表明,HLX37具有優異的抗腫瘤活性且安全性可控,同時能增強腫瘤富集效應,其在多類腫瘤中具有廣泛的應用潛力。該研究結果在2025年美國癌症研究協會(AACR)年會上首次發佈[8]。
未來,復宏漢霖將繼續秉持「以患者為中心」的初心和理念,深耕實體瘤這一重要疾病領域,通過不斷挖掘患者未滿足的臨床需求,持續夯實更多創新分子的差異化佈局,為更多腫瘤患者帶來高質量、可負擔的新型治療方案。
【參考文獻】
[1] Parvez A, Choudhary F, et al. PD-1 and PD-L1: architects of immune symphony and immunotherapy breakthroughs in cancer treatment. Front Immunol. 2023; 14:1296341.
[2] Yu, H., Boyle, T. A., et al. (2016). PD-L1 Expression in Lung Cancer. Journal of thoracic oncology: official publication of the International Association for the Study of Lung Cancer, 11(7), 964–975.
[3] Cozac-Szőke, A. R., Cozac, D. A., et al. (2025). Immune Cell Interactions and Immune Checkpoints in the Tumor Microenvironment of Gastric Cancer. International journal of molecular sciences, 26(3), 1156.
[4] Sun, J. Y., Zhang, D., et al. (2020). Resistance to PD1/PD-L1 blockade cancer immunotherapy: mechanisms, predictive factors, and future perspectives. Biomarker research, 8, 35.
[5] Pérez-Gutiérrez, L., & Ferrara, N. (2023). Biology and therapeutic targeting of vascular endothelial growth factor A. Nature reviews. Molecular cell biology, 24(11), 816–834.
[6] Khan, K. A., & Kerbel, R. S. (2018). Improving immunotherapy outcomes with anti-angiogenic treatments and vice versa. Nature reviews. Clinical oncology, 15(5), 310–324.
[7] Hack, S. P., Zhu, A. X., & Wang, Y. (2020). Augmenting Anticancer Immunity Through Combined Targeting of Angiogenic and PD-1/PD-L1 Pathways: Challenges and Opportunities. Frontiers in immunology, 11, 598877
[8] Song G, Chen Y-S, et al. Abstract 7303: A novel anti-PD-L1/VEGF bispecific antibody (HLX37) with immune checkpoint inhibition, anti-angiogenic, and antineoplastic activities. Cancer Res 15 April 2025; 85 (8_Supplement_1): 7303. AACR Annual Meeting 2025.
