- 繼肺癌、胸腺癌後,HLX43廣譜抗腫瘤潛力持續驗證
- 入選ESMO Asia優選論文口頭報告,HLX43晚期宮頸癌II期臨床數據首發亮相
- 初步臨床療效優異且安全性可控,總人群ORR、DCR分別為41.4%及82.8%,其中3mg/kg劑量組ORR和DCR高達70.0%和100%
2025年12月5日,在2025年歐洲腫瘤內科學會亞洲年會(ESMO Asia)上,復宏漢霖PD-L1 ADC HLX43用於復發/轉移性宮頸癌的II期臨床研究數據以優選論文口頭報告形式首發亮相,展現了令人鼓舞的初步療效,繼非小細胞肺癌、胸腺癌之後,再度印證了該產品在實體瘤領域的廣譜治療潛力。


宮頸癌數據報捷,廣譜潛力再驗證

宮頸癌(CC)、卵巢癌等婦科惡性腫瘤給女性健康造成了嚴重威脅 [1-2],尤其晚期患者預後較差。一線聯合療法治療後,約30%的晚期宮頸癌患者出現疾病復發[3],其5年生存率約為17%[4],包含多西他賽在內的二線化療客觀緩解率(ORR)僅約為13.2%[5],儘管PD-1抑制劑及靶向組織因子(TF)的抗體偶聯藥物(ADC)Tisotumab vedotin已獲批上市,但其治療既往治療失敗的復發轉移性宮頸癌療效也有限,ORR多不到18%[6-9],亟需更高效、臨床獲益更為顯著的治療新選擇。
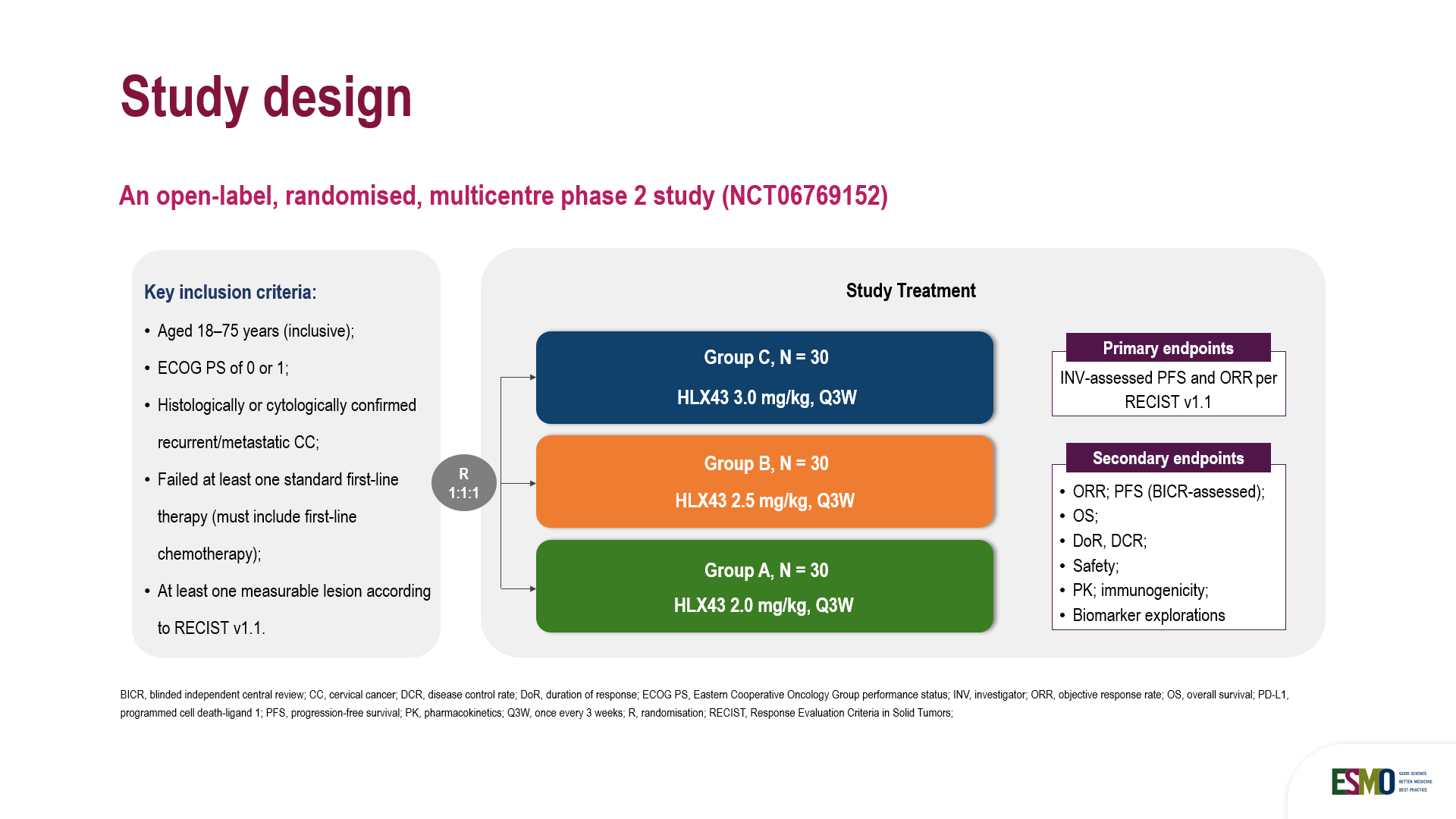
本次發佈基於一項開放、隨機、多中心的II期臨床研究,由山東省腫瘤醫院於金明院士牽頭開展。經組織學確診為復發/晚期宮頸癌(CC)且既往接受過標準一線治療失敗、不耐受或禁忌的患者,按1:1:1比例隨機分組,每3周接受一次劑量為2 mg/kg、2.5 mg/kg或3 mg/kg的HLX43治療。主要終點為研究者根據RECIST v1.1評估的客觀緩解率(ORR)和無進展生存期(PFS)。次要終點包括其他有效性指標、安全性、藥代動力學、免疫原性和生物標誌物探索。
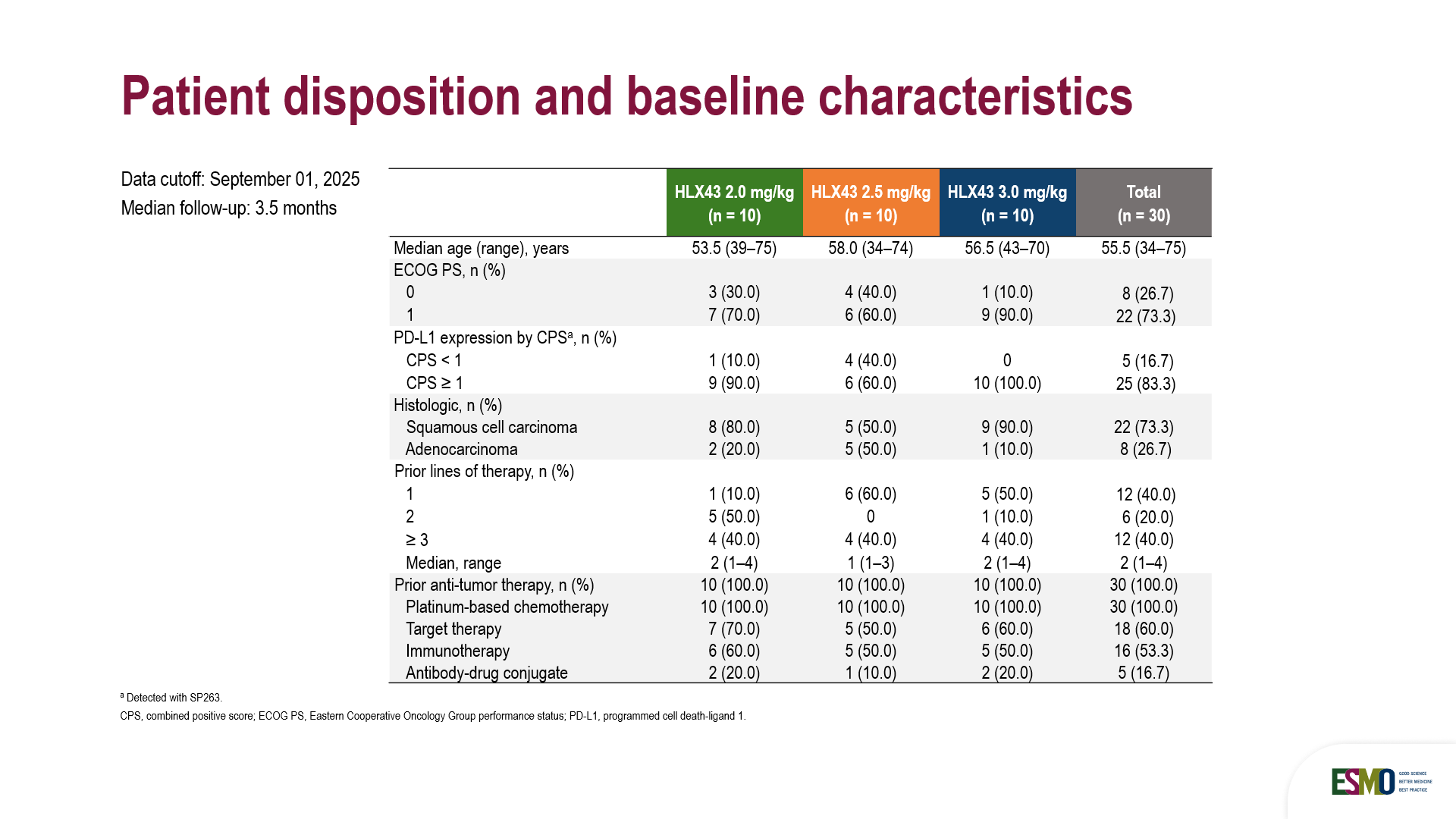
截至2025年9月1日,本研究共納入30例患者,隨機分配接受劑量為2 mg/kg(n=10)、2.5 mg/kg(n=10)和3 mg/kg(n=10)的HLX43治療。其中超過80%的患者PD-L1綜合陽性評分(CPS)≥1。 患者既往接受腫瘤治療的中位線數為2.0(範圍1–4線)。全部患者接受過鉑類藥物化療,60%的患者接受過靶向治療,約50%患者接受過免疫治療,中位隨訪時間為3.5個月。
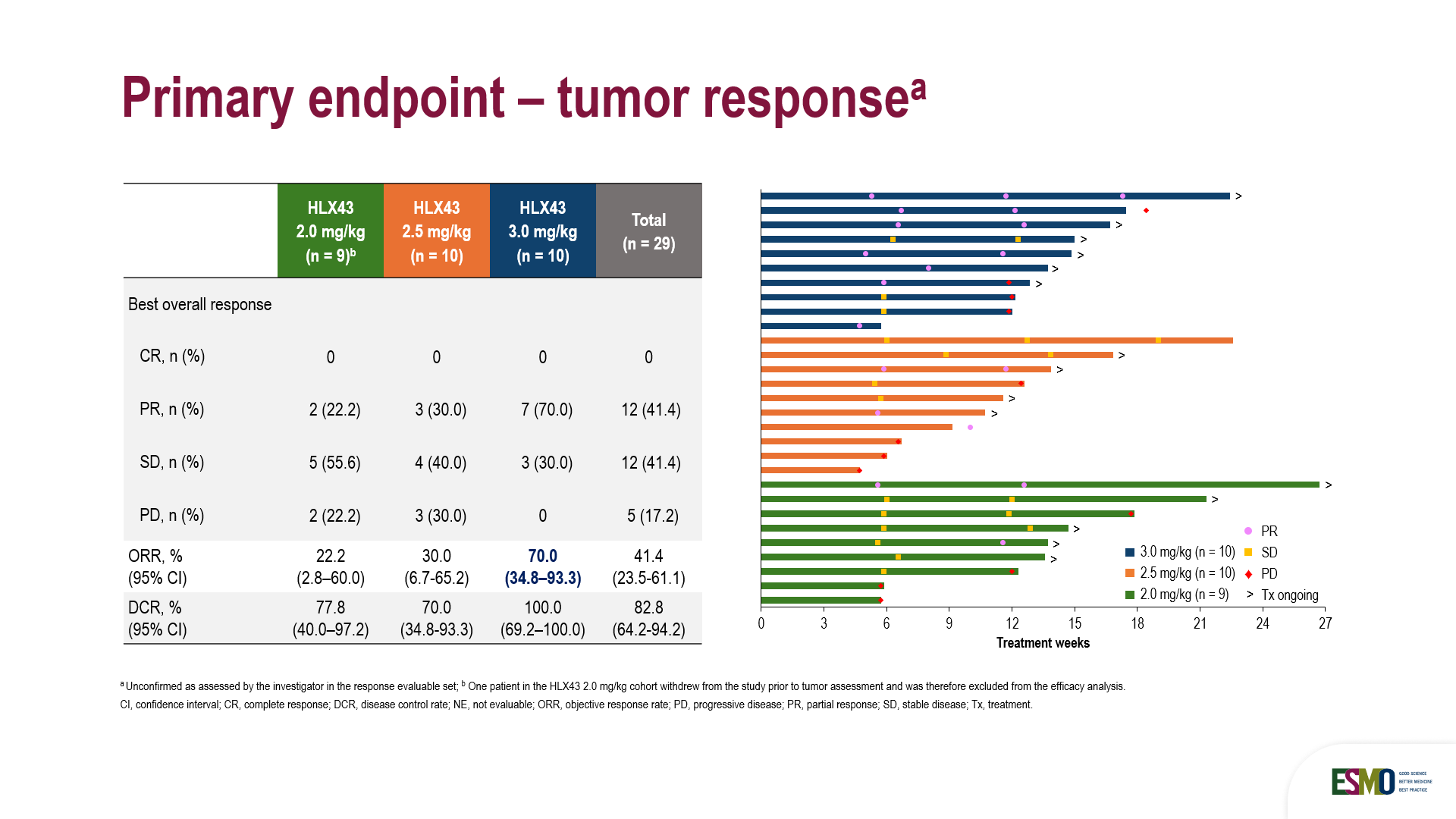
在29例可評估療效的患者中,研究者評估的客觀緩解率(ORR)為41.4%,疾病控制率(DCR)為82.8%。其中,3 mg/kg劑量組的ORR和DCR為70.0%和100%,患者中位PFS尚未達到。
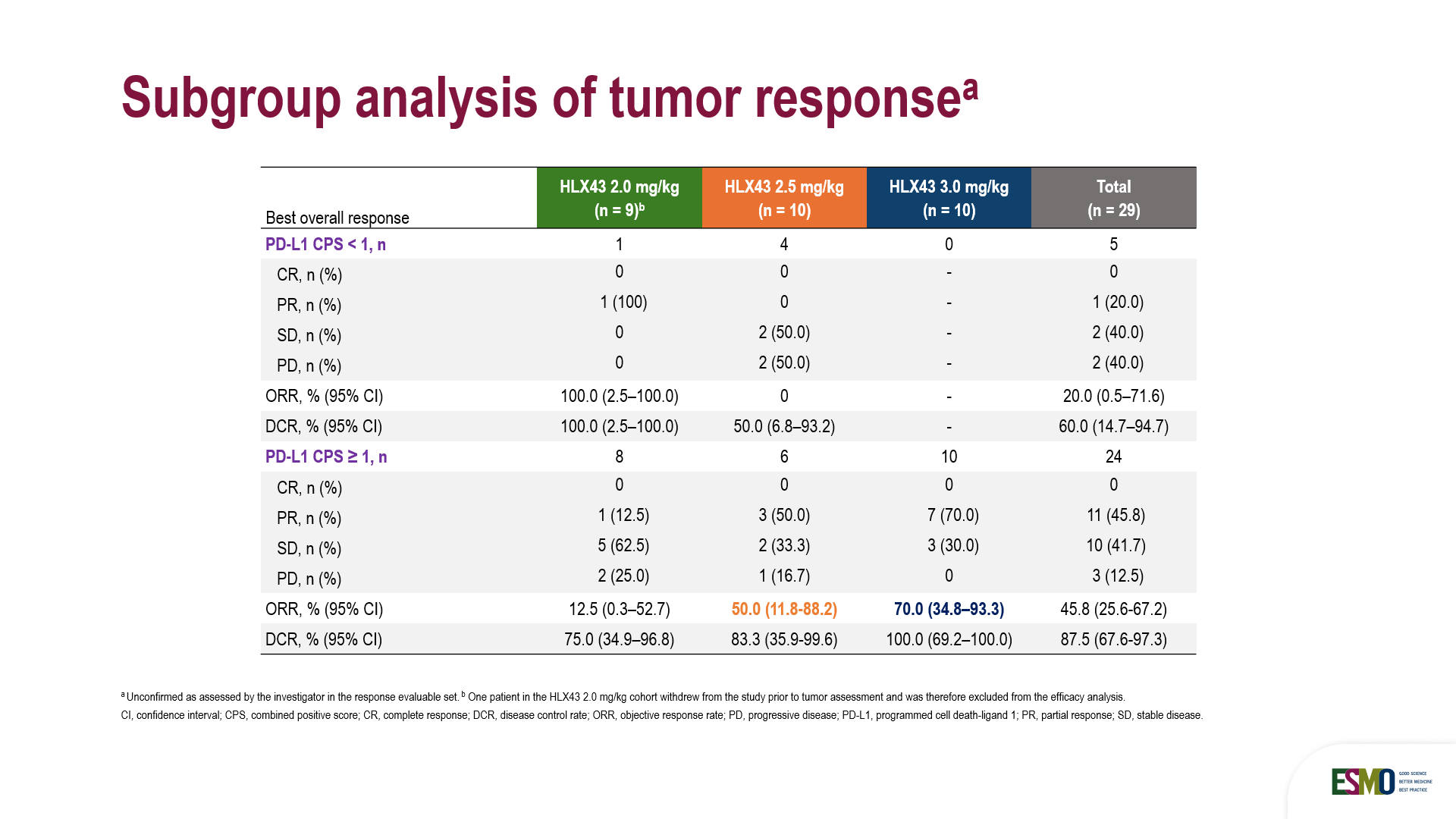
亞組分析顯示,HLX43在CPS≥1的PD-L1陽性晚期宮頸癌患者中初步療效優異,ORR和DCR分別達到 45.8%和 87.5%,並在CPS<1的PD-L1陰性患者中展現了一定療效(1例2mg/kg劑量組患者達到PR),但鑑於此次納入的患者基數較小,且CPS ≥ 1佔比較高(超過80%),仍需待後續更大樣本量的隨機對照研究,以明確HLX43在PD-L1陰性亞組中的確切療效。
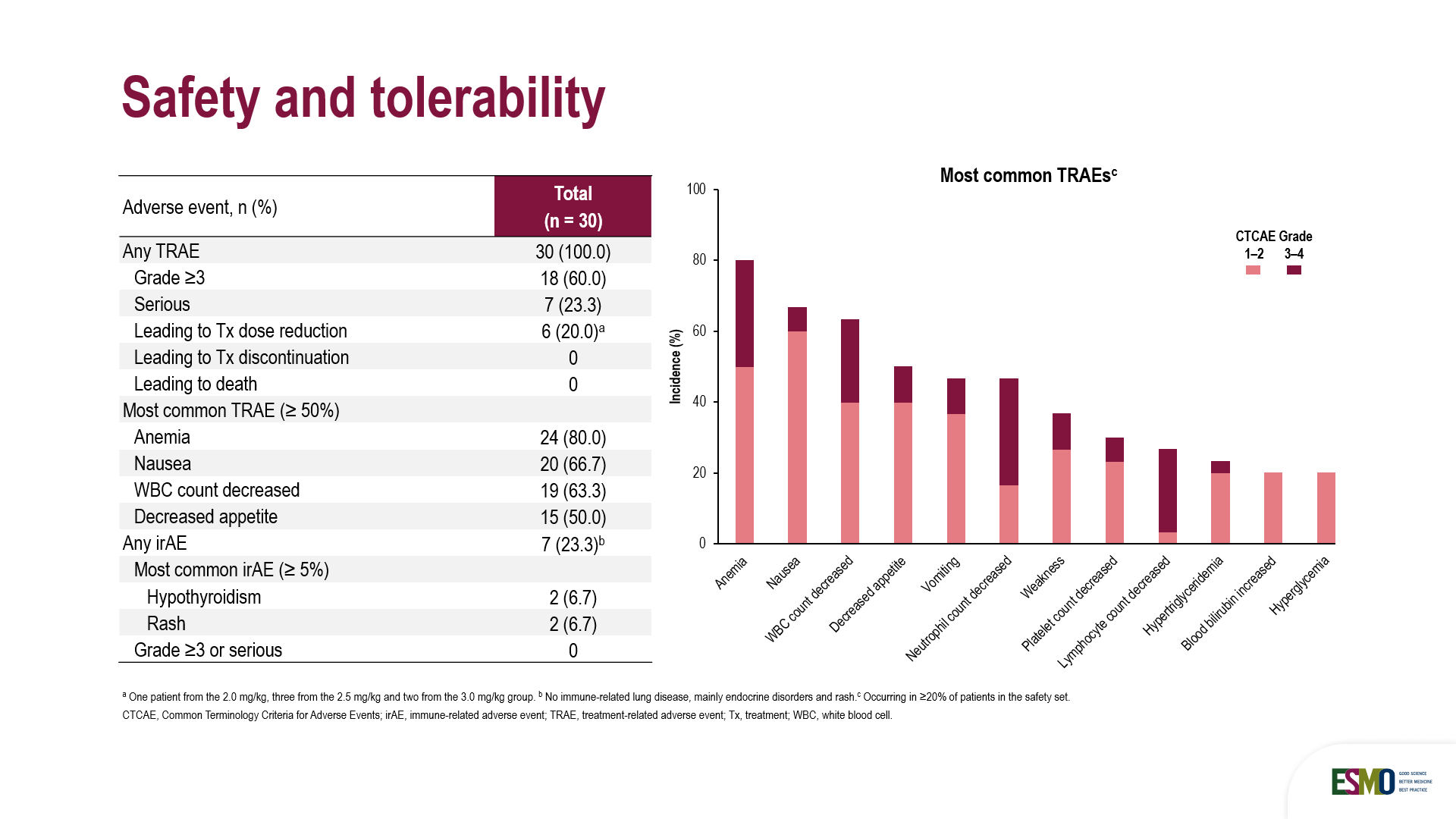
安全性方面,18列(60.0%)患者報告了≥3級治療相關不良事件,主要為可管理的血液學毒性,常見包括為中性粒細胞計數降低(30.0%)、貧血(30.0%)和淋巴細胞計數降低( 23.3%),6例(20.0%)患者因TRAE導致劑量減少,無TRAE導致的患者停止治療(導致停藥的TRAE發生率為0%),且無TRAE導致的死亡。其中,7例(23.3%)患者發生免疫相關不良事件(irAE),主要包括甲狀腺功能減退症等內分泌異常、皮疹等。無患者報告≥3級免疫相關不良事件(irAE),提示了HLX43的IO療效,且免疫相關毒性溫和,具有可控的安全性特徵。
整體來看,HLX43 在復發/晚期宮頸癌(CC)的後線治療中展現出可控的安全性和令人鼓舞的初步療效,尤其在3.0 mg/kg 劑量下療效更為顯著,值得進一步研究。
肺癌療效優異,重磅實力定基石
HLX43是一款潛在同類最優及疾病領域最優的廣譜抗腫瘤ADC,兼具免疫檢查點阻斷與載荷細胞毒性的雙重作用機制。臨床前研究顯示,HLX43在PD-1/PD-L1單抗耐藥的非小細胞肺癌、宮頸癌、食管鱗癌等多個瘤種中展現出治療潛力,且耐受性良好。其I期臨床數據於2025美國臨床腫瘤學會(ASCO)年會及2025 世界肺癌大會(WCLC)上先後發佈,在NSCLC等實體瘤中展現出「高效、低毒」的顯著療效,尤其在NSCLC的治療上,HLX43展現了全人群覆蓋的潛力,對於鱗狀/非鱗狀NSCLC,有無EGFR突變、有無腦轉移、PD-L1陽性/陰性的NSCLC患者人群都具有療效,不依賴生物標誌物篩選。
目前,公司正全力推進HLX43臨床開發進程,在全球入組超過500例患者,其中NSCLC患者超過270例。隨着這一適應症的後線療效逐步得到驗證,未來公司計劃開展更多HLX43在肺癌領域的III期臨床研究,全面覆蓋HLX43頭對頭對比多西他賽的二線臨床研究、HLX43用於NSCLC的一線治療及新輔助治療方案等。同時,HLX43作為全球首個佈局胸腺癌的PD-L1 ADC,其國際多中心臨床研究在中、美、澳等國家同步推進。2025年10月,基於HLX43在胸腺癌後線治療中優異的初步療效,該產品獲得FDA孤兒藥資格認定,有望填補這一罕見高侵襲癌種 ADC治療的空白。
肺癌和胸腺癌之外,復宏漢霖已累計開展約10項HLX43治療多項實體瘤中的臨床研究,廣泛覆蓋宮頸癌等晚期婦科腫瘤、食管鱗癌、頭頸鱗癌、鼻咽癌、結直腸癌、胃癌/胃食管交界部癌、胰腺導管腺癌、肝細胞癌等。其中,HLX43在食管癌、鼻咽癌、胃癌等實體瘤中的概念驗證數據也將在ASCO GI、ASCO、ESMO等大會上陸續讀出。單藥之外,基於HLX43展現出的IO療效,公司積極探索HLX43與其他多元分子如公司自研創新抗EGFR單抗HLX07的聯合治療潛力,不斷挖掘和最大化該產品在臨床中的應用價值。
未來,復宏漢霖將持續聚焦患者未滿足的臨床需求,立足於HLX43等核心創新管線,不斷放大產品的差異化治療潛力,加速推動更大臨床價值的釋放,為全球患者帶來更具突破療效的治療方案。
【參考文獻】
[1] Siegel RL,Giaquinto AN,Jemal A.Cancer statistics,2024.CA Cancer J Clin.2024;74(1):12-49.doi:10.3322/caac.21820
[2] Han B,Zheng R,Zeng H,et al.Cancer incidence and mortality in China,2022.J Natl Cancer Cent.2024;4(1):47-53. Published 2024 Feb 2.doi:10.1016/j.jncc.2024.01.006
[3] Gennigens C, et al. Expert Rev Anticancer Ther. 2021 Jun;21(6):657-671.
[4] Marret G, et al. Expert Opin Biol Ther. 2019 Sep;19(9):871-877.
[5] McLachlan J, et al. Clin Oncol (R Coll Radiol). 2017 Mar;29(3):153-160.
[6] Chung, H. C. et al. Efficacy and safety of pembrolizumab in previously treated advanced cervical cancer: results from the phase II KEYNOTE-158 study. J. Clin. Oncol. 37, 1470–1478 (2019).
[7] Tewari, K. S. et al. Survival with cemiplimab in recurrent cervical cancer. N. Engl. J. Med. 386, 544–555 (2022).
[8] Naumann, R. W. et al. Safety and efficacy of nivolumab monotherapy in recurrent or metastatic cervical, vaginal, or vulvar carcinoma: results from the phase I/II checkMate 358 trial. J. Clin.Oncol. 37, 2825–2834 (2019).
[9] Vergote I, et al. NEJM. 2024 Jul; 391(1):44-55. ADC, antibody-drug conjugate; CC, cervical cancer; DAR, drug-antibody ratio; mPFS, median progression-free survival; ORR, objective response rate; PD-L1, programmed cell death-ligand 1; TME, tumour microenvironment; Top1, topoisomerase 1.








