- HLX43食管鱗癌概念驗證數據首發,為其廣譜抗腫瘤價值再添有力新證
- 初步臨床療效優異且安全性良好,優勢人群獲益潛力顯著,3mg/kg劑量組ORR和DCR分別達61.5%和100%,cORR達38.5%
- 潛在BIC的PD-L1 ADC,「高效低毒」構築明確差異化優勢
2026年1月9日,復宏漢霖(2696.HK)在2026年美國臨床腫瘤學會胃腸道腫瘤研討會(ASCO GI)上,首度公佈了其PD-L1 ADC HLX43治療復發/轉移性食管鱗癌(ESCC)的II期概念驗證(POC)數據,該研究由山東省腫瘤醫院於金明院士牽頭開展。本次發佈的數據初步驗證了HLX43在經治的晚期ESCC患者中的治療潛力,展現出令人鼓舞的療效及良好的安全性。HLX43已在非小細胞肺癌、宮頸癌、食管鱗癌及胸腺癌等多項實體瘤適應症中觀察到持續且一致的療效和安全性趨勢,其廣譜抗腫瘤潛力正通過臨床實踐逐步得到驗證,為後續拓展更多適應症奠定重要基礎。
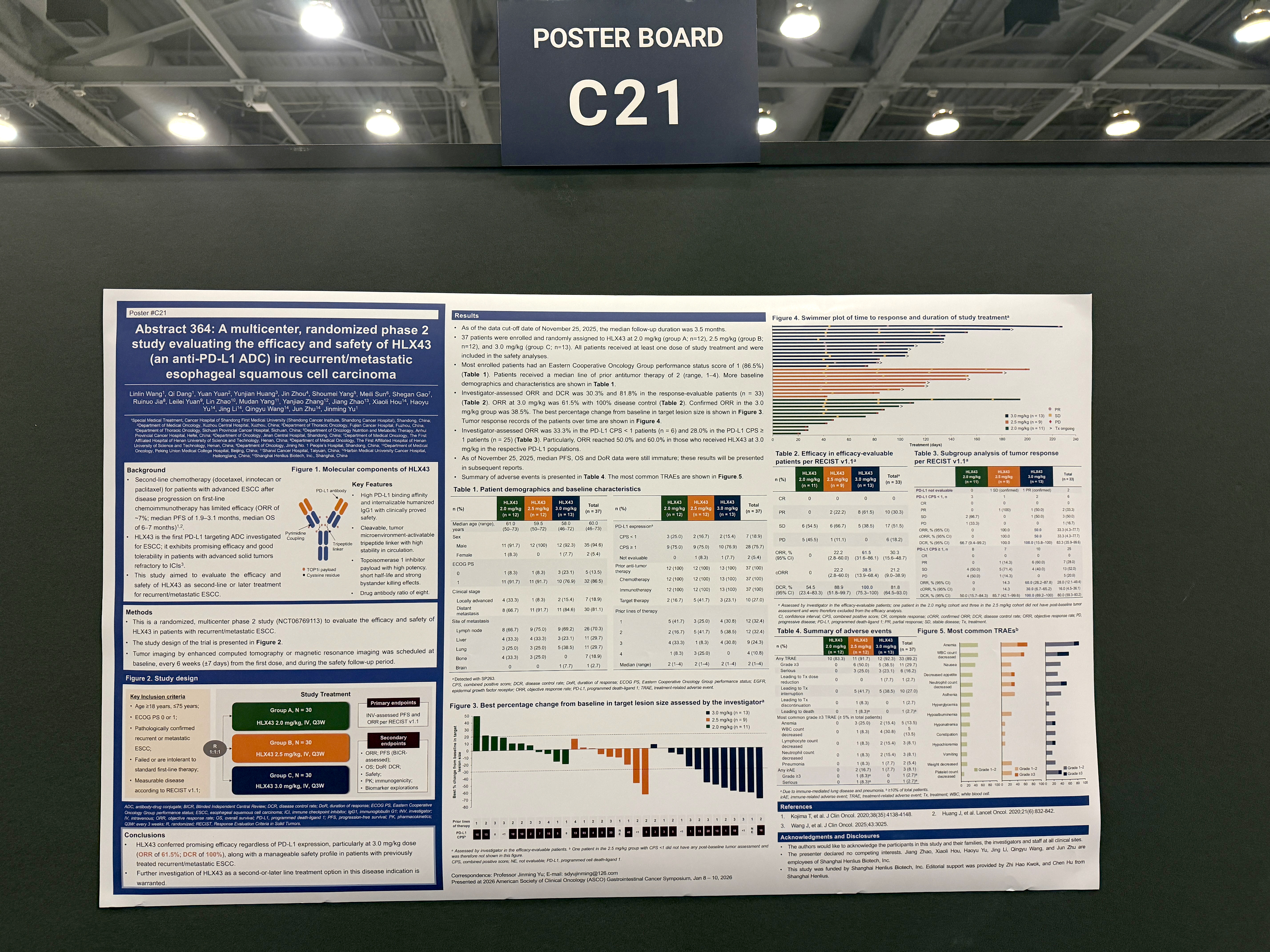

食管癌是全球範圍內常見的惡性腫瘤,2022年全球新發食管癌約51.1萬例,死亡約44.5萬例[1]。中國是該疾病最為高發的國家,根據2022年腫瘤登記數據,我國食管癌年發病22.4萬例,死亡18.8萬例,發病與死亡人數佔全球近一半[2]。其中食管鱗癌(ESCC)是主要的病理類型。尤其在中國等高發地區,ESCC佔比高達90%以上[3]。近年來,免疫聯合化療已成為中外權威指南推薦的標準一線方案,顯著改善了患者生存。但對免疫化療失敗後的難治人群,多西他賽、伊立替康等二線化療的客觀緩解率(ORR)僅約7%,中位總生存期(mOS)僅為5-7個月[4, 5],療效極為有限。對於二線治療再次失敗的患者,目前全球範圍內尚無標準的三線治療方案,可見ESCC的後線治療仍存在巨大的未滿足臨床需求。
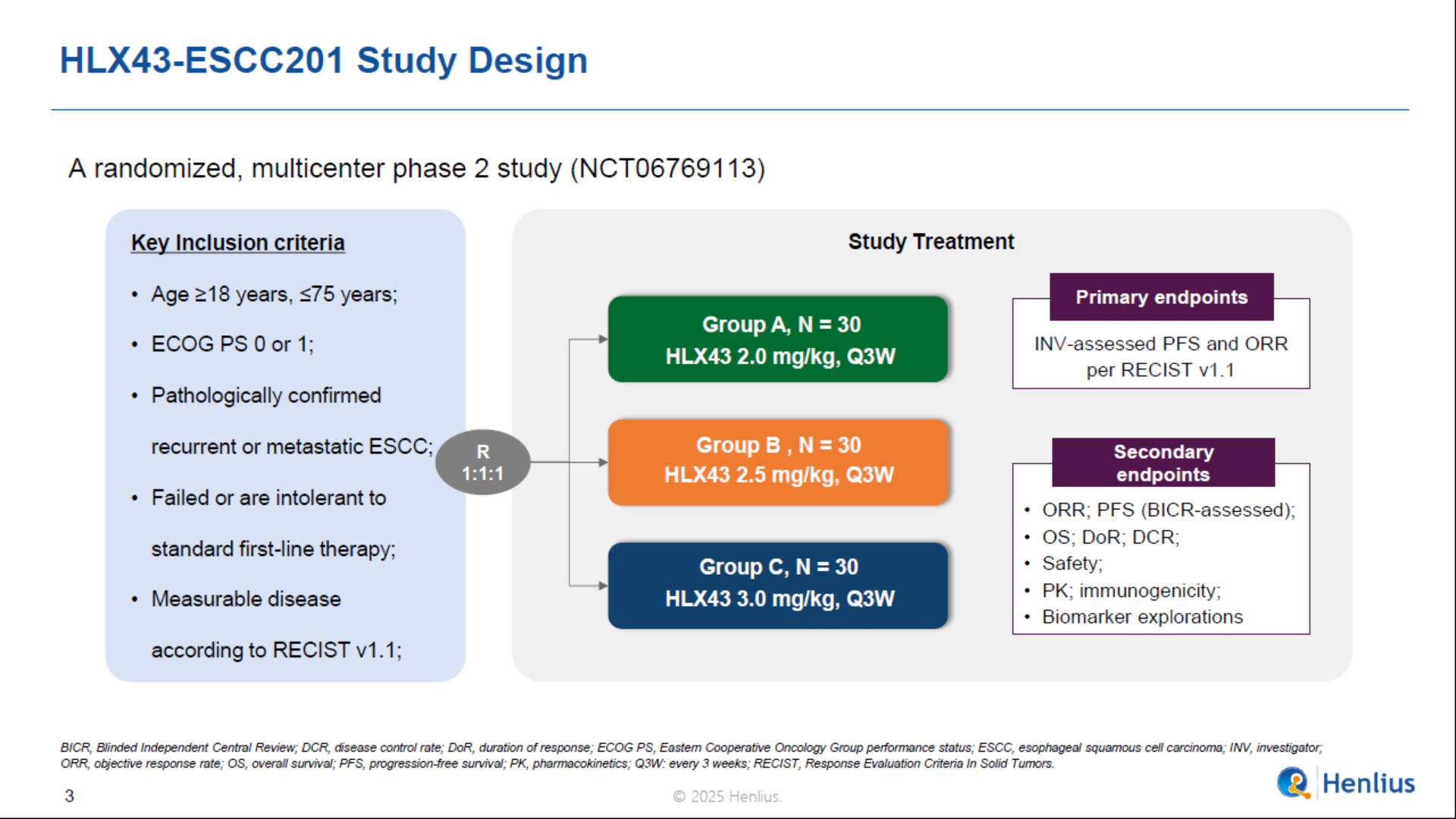
本次發佈基於一項評估 HLX43 在復發/轉移性食管鱗癌中有效性和安全性的多中心、隨機的II 期臨床研究。研究入組了經組織學或細胞學確診的復發/轉移性ESCC的患者,接受一線化免治療後進展或不耐受,並按1:1:1的比例隨機分組,接受每3周一次靜脈注射2 mg/kg、2.5 mg/kg或3 mg/kg 的HLX43。主要終點為研究者根據RECIST v1.1評估的客觀緩解率(ORR)和無進展生存期。次要終點包括其他有效性終點、安全性、藥代動力學、免疫原性和生物標誌物探索。
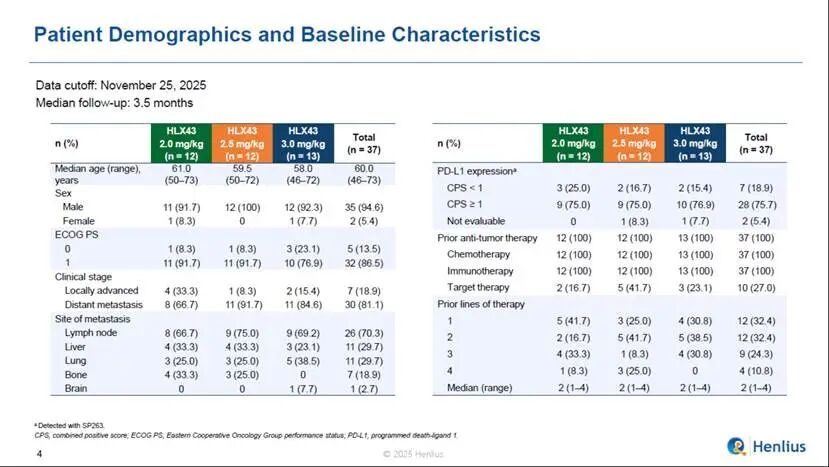
截至數據截止日期2025年11月25日,共有37名患者隨機分組並接受HLX43治療,劑量分別為2 mg/kg(n = 12)、2.5 mg/kg(n = 12)和3 mg/kg(n = 13)。大多數患者的ECOG PS評分為1(86.5%)。既往抗腫瘤治療線數中位數為2(範圍,1–4)。全部患者(100%)接受過化療及免疫治療,27.0%的患者接受過靶向治療,CPS≥1患者佔75.7%,中位隨訪時間為3.5個月。
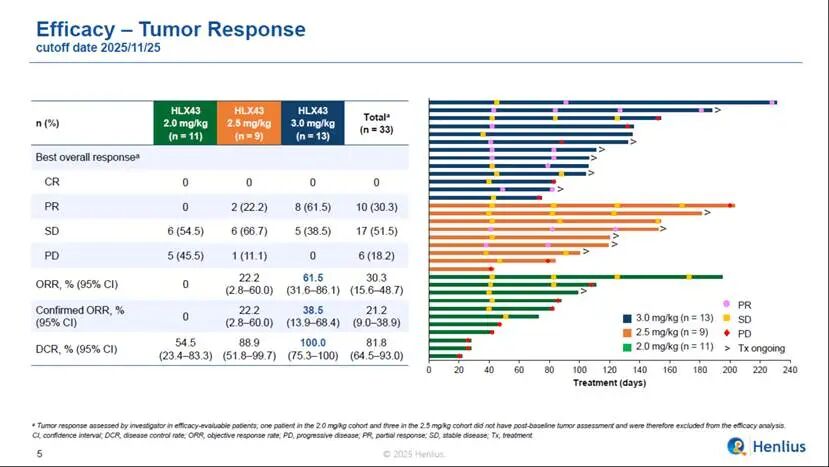
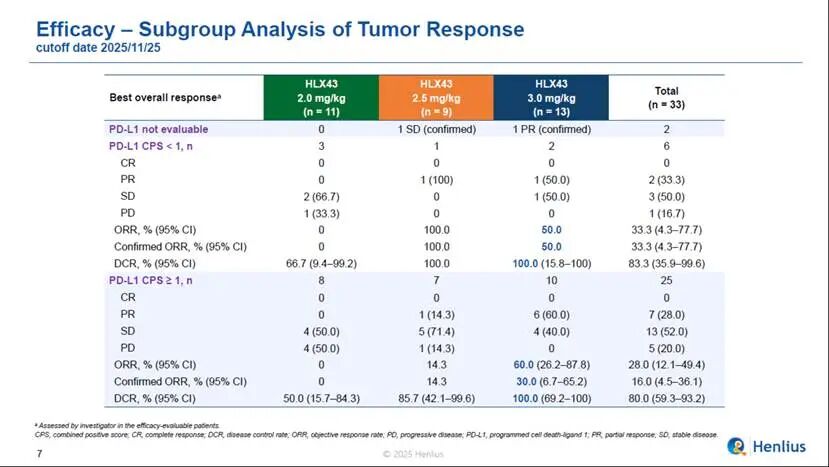
33例療效可評估的患者中,觀測到了積極信號,ORR為30.3%,DCR為81.8%。尤為值得關注的是,在3 mg/kg劑量組的13例療效可評估的患者中,8例患者達到了部分緩解,ORR為61.5%,DCR為100.0%,確認的ORR(cORR)為38.5%;3 mg/kg劑量下,CPS≥1的PD-L1陽性患者(n = 10)中,ORR為60.0%,DCR為100%;CPS<1的PD-L1陰性患者(n=2)ORR為50%,DCR為100%,初步提示HLX43療效不限患者PD-L1表達限制,但仍待後續更大樣本量的隨機對照研究進一步驗證。
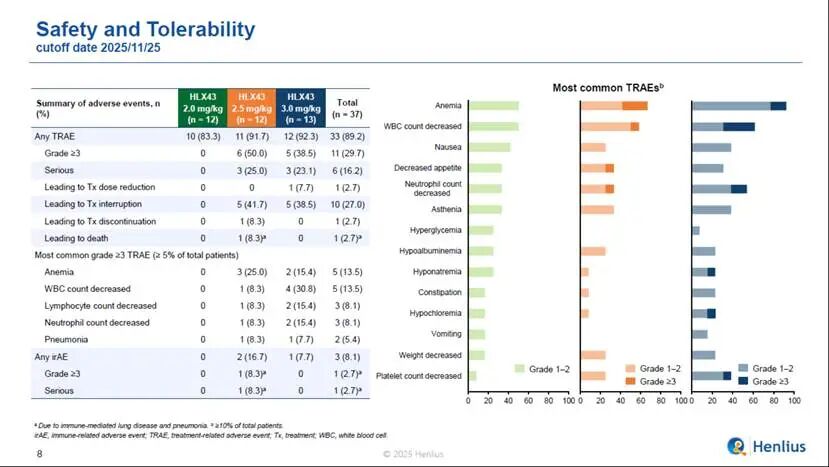
安全性方面,33例患者(89.2%)發生了治療相關不良事件(TRAEs),其中11例患者(29.7%)報告了≥3級TRAEs,最常見的≥3級TRAEs(發病率≥5%)包括貧血(13.5%)、白細胞計數下降(13.5%)、淋巴細胞計數降低(8.1%)、中性粒細胞計數降低(8.1%)、肺炎(5.4%)等。TRAEs導致1例(2.7%)患者用藥劑量減少,1例(2.7%)患者永久停藥,1例患者死亡。其中,在療效信號更為顯著的3mg/kg劑量組中,HLX43安全性良好,5例患者(38.5%)報告了≥3級TRAEs,1例患者(7.7%) 因TRAEs導致用藥劑量減少,無患者(0%)因TRAE導致永久停藥或死亡。
綜上所述,HLX43 在復發/轉移性食管鱗癌(ESCC)的後線治療中展現出可控的安全性和令人鼓舞的初步療效,尤其在3.0 mg/kg 劑量下療效更為顯著,值得進一步研究。
HLX43是一款潛在同類最優及疾病領域最優的廣譜抗腫瘤ADC,兼具免疫檢查點阻斷與載荷細胞毒性的雙重作用機制。臨床前研究顯示,HLX43在PD-1/PD-L1單抗耐藥的非小細胞肺癌、宮頸癌、食管鱗癌等多個瘤種中展現出治療潛力,且耐受性良好。其I期臨床數據於2025美國臨床腫瘤學會(ASCO)年會及2025 世界肺癌大會(WCLC)上先後發佈,在NSCLC等實體瘤中展現出「高效、低毒」的顯著療效,尤其在NSCLC的治療上,HLX43展現了全人群覆蓋的潛力。
目前,復宏漢霖已累計開展約10項HLX43治療多項實體瘤中的臨床研究,在全球入組超過500例患者,廣泛覆蓋肺癌、宮頸癌等晚期婦科腫瘤、食管鱗癌、頭頸鱗癌、鼻咽癌、結直腸癌、胃癌/胃食管交界部癌、胰腺導管腺癌、肝細胞癌等,其中NSCLC患者超過300例。後續,HLX43在鼻咽癌、頭頸鱗癌等實體瘤中的概念驗證數據也將在2026 ASCO、ESMO等大會上陸續讀出。單藥之外,基於HLX43展現出的IO療效,公司積極探索HLX43與其他多元分子如公司自研創新抗EGFR單抗HLX07的聯合治療潛力,不斷挖掘和最大化該產品在臨床中的應用價值。
未來,復宏漢霖將持續聚焦患者未滿足的臨床需求,立足於HLX43等核心創新管線,不斷放大產品的差異化治療潛力,加速推動更大臨床價值的釋放,為全球患者帶來更具突破療效的治療方案。
【參考文獻】
[1] Siegel RL,Giaquinto AN,Jemal A.Cancer statistics,2024.CA Cancer J Clin.2024;74(1):12-49.
[2] Han B, Zheng R, et al. Cancer incidence and mortality in China, 2022. J Natl Cancer Cent. 2024 Feb 2;4(1):47-53.
[3] 中華腫瘤雜誌(Chinese Journal of Oncology). 2019;41(1):19-28.
[4] Kojima T, Shah MA, et al. KEYNOTE-181 Investigators. Randomized Phase III KEYNOTE-181 Study of Pembrolizumab Versus Chemotherapy in Advanced Esophageal Cancer. J Clin Oncol. 2020 Dec 10;38(35):4138-4148.
[5] Huang J, Xu J, et al. ESCORT Study Group. Camrelizumab versus investigator's choice of chemotherapy as second-line therapy for advanced or metastatic oesophageal squamous cell carcinoma (ESCORT): a multicentre, randomised, open-label, phase 3 study. Lancet Oncol. 2020 Jun;21(6):832-842.
